- Hutchmed
- | 公告及新闻稿
收入增长97%(按固定汇率计算为102%)至8.38亿美元,净收益为1.01亿美元
我们自主研发的药物FRUZAQLA™(呋喹替尼)取得首个美国FDA批准
索乐匹尼布用于治疗免疫性血小板减少症的中国新药上市申请已获受理,并获纳入优先审评及突破性治疗品种
和黄医药(中国)有限公司(简称“和黄医药”、“本公司”或“我们”)是一家处于商业化阶段的创新型生物医药公司,今日公布截至2023年12月31日止年度的财务业绩,以及提供关键临床项目和商业化发展的最新进展。公司将于今天中国香港时间晚上8时30分/ 格林尼治标准时间下午12时30分/ 美国东部时间上午7时30分举行业绩电话会议及网络直播(英语场次),并于2024年2月29日(星期四)中国香港时间上午8时30分举行中文(普通话)场次。
除另有说明外,所有金额均以美元列示。
战略:全球愿景、对患者的承诺以及通往可持续业务的道路
- 实现将我们的创新药物推向国际的全球愿景,正如与武田[1](Takeda)的合作所证明,带来了4.35亿美元的首付款和里程碑付款,外加生产收入和基于凈销售额的特许权使用费,为我们的管线中的其他产品提供战略参考价值。
- 我们严于律己,在建立自给自足可持续的业务的道路上稳步前行,充分发挥我们在研发[2]领域的专长,并通过授权和商业化创造价值。
产品及管线:呋喹替尼在全球和中国扩展版图、索乐匹尼布中国新药上市申请[3]审评、赛沃替尼非小细胞肺癌[4]完成入组
- 呋喹替尼(fruquintinib)较原定的PDUFA[5]目标审评日期提前三周,获美国FDA[6]批准用于三线结直肠癌[7],随后由武田迅速推出市场,并获纳入NCCN[8]指南,并在美国取得市场销售额[9]1,510万美元。在全球注册审批进展方面, 向EMA[10]提交的上市许可申请[11]已于2023年6月获确认,并于2023年9月向PMDA[12]提交了新药上市申请。
- 呋喹替尼用于二线治疗胃癌的新药上市申请已于中国获受理。呋喹替尼和信迪利单抗联合疗法用于二线治疗子宫内膜癌[13]和二线治疗肾细胞癌[14]的中国注册研究已于2023年完成患者招募,计划于2024年年初向国家药监局[15]提交子宫内膜癌的新药上市申请,并预计将于2024年年底公布肾细胞癌的顶线结果。
- 索乐匹尼布(sovleplenib,一种新型Syk[16]抑制剂)用于原发免疫性血小板减少症[17]的中国新药上市申请已获受理,并获纳入优先审评,已达到所有终点的III期临床试验(ESLIM-01研究)的数据支持了此项上市申请。
- 赛沃替尼(savolitinib)用于治疗非小细胞肺癌的关键性全球II期临床试验SAVANNAH研究,已完成患者招募,随后有望于2024年年底由阿斯利康[18]向美国FDA提交新药上市申请。
展望及财务:预计产品收入强劲增长及开支减少;现金充足
- 2023年,总收入增长97%(按固定汇率[19]计算为102%)至8.38亿美元,肿瘤/免疫业务综合收入增长223%(按固定汇率计算为228%)至5.286亿美元,接近财务指引上限,包括确认自武田收取的首付款中的2.8亿美元。和黄医药应占净收益达到1.008亿美元。
- 2024 年肿瘤/免疫业务综合收入财务指引为3.0亿至4.0亿美元,得益于已上市的肿瘤产品销售额及特许权使用费30% 至 50%的目标增长。
- 更集中的研发开支,与我们的专注于关键项目的战略一致。
- 更强劲的现金状况,至2023年年末现金余额为 8.863亿美元(2022 年:6.31 亿美元),确保和黄医药正稳步实现成为一家自给自足可持续的公司的目标。
2023年全年业绩及最新业务进展
和黄医药执行主席杜志强先生表示:“我们在2023年取得了重要的进展。随着FRUZAQLA™于2023年11月取得美国FDA批准,我们在继续致力于实现建立自给自足可持续业务的同时,兑现了将和黄医药的创新药物带给全球患者的承诺。与武田的合作作为中国生物医药历史上最大的小分子海外授权交易之一,进一步增强了我们的现金状况,带来4.35亿美元现金。武田在获批后的48小时内就成功推出产品于美国上市,并在其后初步展现出强劲的患者接受度。”
“在2024年我们将继续落实我们的战略,通过在中国提高创新药销售以及在海外与合作伙伴共同推动产品进入市场的均衡战略,我们将继续专注于实现建立自给自足可持续的业务的目标。再加上我们专注于管线推进和进一步的商务开发,尽管全球宏观经济环境仍然充满不确定因素,和黄医药仍将蓬勃发展,并持续将创新药物带向世界各地越来越多的患者。”
和黄医药首席执行官兼首席科学官苏慰国博士表示:“和黄医药在2023年取得了令人瞩目的财务业绩,收入达8.38亿美元,增长了97%。再加上我们的现金状况也显著增强,余额达8.86亿美元,都将帮助我们继续推进产品管线并成功执行我们的战略。”
“2023 年对于我们来说是重要的一年,尤其是对于呋喹替尼而言,基于成功的FRESCO-2研究,我们完成了在美国、欧洲和日本的上市许可申请提交。继取得美国FDA批准用于三线治疗晚期结直肠癌后,我们将继续与武田合作寻求呋喹替尼在全球更多新的市场上市。在中国,我们还基于 FRUTIGA 研究提交了二线胃癌的新药上市申请。”
“另一个里程碑则是索乐匹尼布在中国治疗免疫性血小板减少症患者的ESLIM-01 注册研究取得成功,索乐匹尼布是我们在免疫性疾病领域的第一款潜在创新药物。 其新药上市申请已于 2024 年 1 月获得国家药监局受理并获纳入优先审评。中国新增和现有的免疫性血小板减少症成人患者约达25万名[20]。目前的治疗选择仅限于类固醇和 TPO/TPO-RA[21],仍然存在巨大未满足的医疗需求,而索乐匹尼布凭借其创新的作用机制和良好的安全性,有望为之提供解决方案。Syk抑制或可应用于其他类似的重要疾病,如类风湿性关节炎。 我们还计划在2024 年启动索乐匹尼布的海外临床开发。”
“至于赛沃替尼,我们完成了治疗MET[22] 外显子14跳跃突变非小细胞肺癌患者的确证性临床试验,预计将于2024 年第一季度提交新药上市申请,有望将在中国的标签适应症拓展到包括一线患者。在中国以外地区,我们将继续与阿斯利康合作推进赛沃替尼治疗肺癌的关键性全球研究SAVANNAH,若取得理想的数据将有望用于支持向美国FDA提交上市申请。该项在泰瑞沙®(TAGRISSO®)治疗后疾病进展的EGFR[23]突变非小细胞肺癌患者开展的临床试验已完成患者招募,并于2023年1月获美国FDA授予快速通道资格,我们有望于2024年年底提交新药上市申请。我们相信,赛沃替尼作为与领先的第三代EGFR TKI[24]泰瑞沙®联合用药的口服药物,其便捷的给药方法、靶向疗效和安全性,都将使其在激烈的市场竞争中处于有利地位,并解决MET阳性非小细胞肺癌患者未被满足的需求。”
“我们的中国商业化团队工作进展顺利,成功按照现行条款完成呋喹替尼和索凡替尼(surufatinib)的国家医保药品目录[25]续约,未有进一步降价。其市场销售在2023年实现了强劲的增长。在未来的两年,通过拓展适应症和推动新产品上市,加上FRUZAQLA™海外商业化带来的收入,我们计划在中国进一步发展。”
I. 商业营运
2023年,总收入增长97%(按固定汇率计算为102%)至8.38亿美元(2022年:4.264亿美元),得益于与武田的合作、我们于中国的强劲商业化进展及第三方分销的增长, 2023年净收益达到1.01亿美元。
肿瘤/免疫业务综合收入增长223%(按固定汇率计算为228%)至5.286亿美元(2022年:1.638亿美元);接近财务指引上限,得益于确认了来自武田的首付款中2.8亿美元的合作收入、取得美国FDA批准后里程碑付款中的3,200万美元,以及因我们的产品销售的强劲增长,市场销售额增长28%(按固定汇率计算为35%)至2.136亿美元(2022年:1.671亿美元);
- 爱优特®(ELUNATE®,呋喹替尼的中国商品名)2023年的市场销售额增长15%(按固定汇率计算为22%)至1.075亿美元(2022年:9,350万美元),反映其市场份额维持领先地位;
- FRUZAQLA™(呋喹替尼的美国商品名)2023年的市场销售额为1,510万美元,反映其在2023年11月于美国上市;
- 苏泰达®(SULANDA®,索凡替尼)2023年的市场销售额增长36%(按固定汇率计算为43%)至4,390万美元(2022年:3,230万美元),反映出在获纳入国家医保药品目录两年后,其市场占有率不断增长;
- 沃瑞沙®(ORPATHYS®,赛沃替尼)2023年的市场销售额增长12%(按固定汇率计算为19%)至4,610万美元(2022年:4,120万美元)。第一季度销售额受到2023年3月1日国家医保药品目录正式生效前惯例的渠道波动影响,2023年后三个季度的销售额较2022年同期增长30%;
- 研发服务收入增长116%(按固定汇率计算为119%)至5,240万美元(2022年:2,420万美元),现在亦包括来自我们的新合作伙伴武田的监管注册活动管理费用;
- 已收到来自武田4亿美元的首付款,其中2.8亿美元确认为2023年收入,其余部分将在服务和履约义务完成时确认;及
- 尽管面临年初新冠肺炎所造成的影响以及2023年下半年的中国医药行业反腐行动的挑战,成功的商业营运管理令肿瘤医院和医生覆盖范围得以扩大。进入医院和相关活动受到更多限制,但从2023年10月起有所改善。
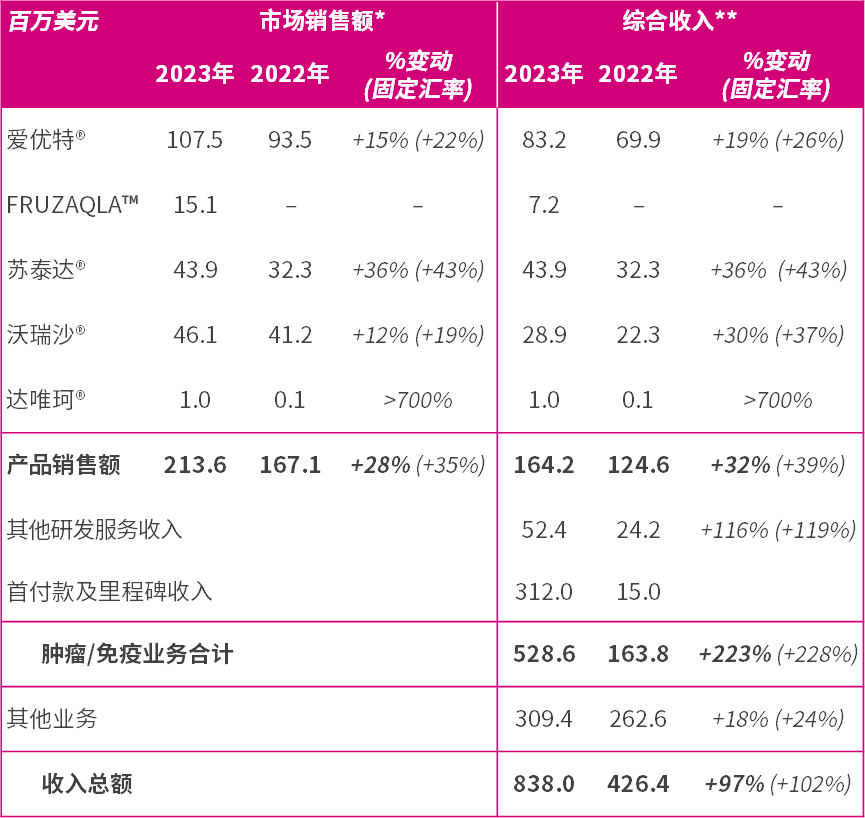
* = 就爱优特®、FRUZAQLA™和沃瑞沙®,主要分别代表礼来[26]、武田和阿斯利康提供的对第三方的总销售额。
** = 就爱优特®,代表礼来向和黄医药支付的药品供应、商业服务费和特许权使用费以及由和黄医药开具发票的对其他第三方的销售额;就FRUZAQLA™,代表武田支付的药品供应和特许权使用费;就沃瑞沙®,代表阿斯利康向和黄医药支付的药品供应和特许权使用费以及由和黄医药开具发票的对其他第三方的销售额;就苏泰达®及达唯珂®,代表和黄医药对第三方的产品销售额。
II.注册审批进展
中国
- 2023年4月,呋喹替尼和紫杉醇(paclitaxel)的联合疗法用于二线治疗胃癌的新药上市申请获受理;
- 2024年1月,继2023年获纳入优先审评后,索乐匹尼布用于原发免疫性血小板减少症的新药上市申请获受理;
- 2023年7月,呋喹替尼和信迪利单抗(sintilimab)的联合疗法获纳入突破性治疗药物品种用于二线治疗子宫内膜癌;
- 2024年1月,呋喹替尼于中国香港获批用于三线治疗结直肠癌;及
- 2023年3月,沃瑞沙®(赛沃替尼)和达唯珂®(TAZVERIK®,他泽司他/tazemetostat)于中国澳门获批。
中国以外
- 继2023年5月获予以优先审评后,呋喹替尼于2023年11月取得美国FDA批准,用于经治转移性结直肠癌患者;
- 2023年9月,向日本PMDA提交了呋喹替尼的新药上市申请;
- 2023年6月,向EMA提交的呋喹替尼上市许可申请获确认;及
- 2023年1月,赛沃替尼与泰瑞沙®联合治疗具有MET过表达及/或扩增的非小细胞肺癌患者(患者于既往使用泰瑞沙®期间或之后出现疾病进展)获美国FDA授予快速通道开发项目资格。
III.后期临床项目进展
赛沃替尼(中国商品名:沃瑞沙®)是一种高选择性口服MET抑制剂,正广泛地于MET驱动的肺癌、胃癌和乳头状肾细胞癌患者群体中进行临床开发
- 完成关键性全球II期SAVANNAH研究的患者招募(NCT03778229),该研究在因MET扩增或过表达导致泰瑞沙®治疗后疾病进展的非小细胞肺癌患者中展开,已获美国FDA授予快速通道开发项目资格,并有望用于加速审批。与泰瑞沙®的联合疗法的全球关键性III期SAFFRON研究继续入组中(NCT05261399),为SAVANNAH研究提供进一步支持;
- 在MET外显子14跳跃突变的非小细胞肺癌患者中展开的中国IIIb期确证性研究的一线治疗队列公布了积极的结果(NCT04923945);二线治疗队列的患者招募已完成;及
- 启动了三线治疗伴有MET扩增胃癌患者中国II期研究的注册阶段(NCT04923932)。
赛沃替尼潜在的临床和监管关键进展:
- 于2024年年初提交用于一线及二线治疗MET外显子14跳跃突变非小细胞肺癌患者的中国新药上市申请;
- 于2024年年底完成SACHI研究的患者招募(NCT05015608),与泰瑞沙®的联合疗法用于治疗EGFR抑制剂治疗后疾病进展的MET扩增的非小细胞肺癌患者的一项中国关键性III期研究;
- 于2024年年底完成SANOVO 研究的患者招募(NCT05009836), 与泰瑞沙®的联合疗法用于治疗伴有EGFR突变和MET过表达的非小细胞肺癌患者的一项中国关键性III期研究 ;及
- 若SAVANNAH研究取得积极结果,于2024年年底左右与美国FDA就可能的新药上市申请提交进行沟通。
呋喹替尼(中国商品名:爱优特®,美国商品名:FRUZAQLA™),是一种高选择性的VEGFR[27] 1/2/3口服抑制剂,旨在提高激酶选择性,从而降低脱靶毒性、提高药物暴露、达到持续的靶点抑制,并具有潜在用于联合疗法的灵活性
- 2024年2月,于ASCO[28] Plenary(美国临床肿瘤学会全体大会)上公布了呋喹替尼联合紫杉醇用于二线治疗胃癌患者的FRUTIGA研究的结果(NCT03223376)。PFS[29]、ORR[30]和DCR[31]终点均取得具有统计学意义的显著改善。尽管整体OS[32]改善未达统计学意义,但在排除接受后续抗肿瘤治疗的患者后的预设分析中,OS改善达到了统计学意义上的显著改善;
- 2023年7月,完成了FRUSICA-1研究的患者招募(NCT03903705),一项呋喹替尼和PD-1[33]抗体信迪利单抗联合疗法的中国II期研究的子宫内膜癌注册队列;
- 2023年12月,完成了FRUSICA-2研究的患者招募(NCT05522231),一项呋喹替尼和PD-1抗体信迪利单抗联合疗法治疗肾透明细胞癌的中国II/III期研究;
- 于ASCO 2023年年会上公布呋喹替尼和PD-1抗体信迪利单抗联合疗法中国II期研究的肾透明细胞癌队列的最新结果(NCT03903705);及
- 2023年6月,用于治疗经治转移性结直肠癌患者的FRESCO-2全球III期注册研究的积极结果在同行评审期刊在《柳叶刀(The Lancet)》上发表(NCT04322539)。
呋喹替尼潜在的临床和监管关键进展:
- 于2024年年中完成治疗经治转移性结直肠癌的EMA 上市许可申请审评;
- 于2024年年底完成治疗经治转移性结直肠癌的PMDA 新药上市申请审评;
- 于2024年年初向国家药监局提交用于二线治疗子宫内膜癌的注册申请;及
- 于2024年年底左右公布肾透明细胞癌II/III期注册研究的顶线结果。
索凡替尼(中国商品名:苏泰达®)是一种VEGFR、FGFR[34]及CSF-1R[35]的口服小分子抑制剂,旨在用于抑制肿瘤血管生成,并通过调节肿瘤相关巨噬细胞以促进对肿瘤细胞的免疫应答
- 于AACR[36]及ASCO 2023年年会上公布与特瑞普利单抗(toripalimab,一种PD-1 抗体)联合疗法的中国Ib/II期研究的数据(NCT04169672);及
- 一项由研究者发起的索凡替尼与PD-1抗体和化疗联合疗法用于一线治疗胰腺导管腺癌患者的临床试验,于ASCO 2023年年会上公布了令人鼓舞的早期结果。
索乐匹尼布(HMPL-523)是一种研究性的高选择性口服Syk抑制剂,Syk是Fc受体和B细胞受体信号传导通路的关键组成部分
- 治疗原发免疫性血小板减少症成人患者的关键性中国III期研究到达主要终点和所有次要终点(NCT05029635);及
- 治疗温抗体型自身免疫性溶血性贫血[37]的中国II期概念验证研究已达到主要终点(NCT05535933),并计划开展III期注册研究。
索乐匹尼布潜在的临床关键进展:
- 于2024年年中提交ESLIM-01研究结果以供发表和/或公布;及
- 于2024年年中在美国/欧洲启动一项用于治疗免疫性血小板减少症的剂量探索研究。
他泽司他(中国澳门及海南先行区商品名:达唯珂®)是一种由Ipsen[38]授权的同类首创EZH2口服抑制剂
- 2023年9月,完成滤泡性淋巴瘤中国桥接研究的患者招募,以支持在美国获批的基础上寻求附条件批准(NCT05467943);
- 2023年3月,在中国澳门特别行政区获批上市;及
- 在既往接受过至少两种治疗后复发或难治性滤泡性淋巴瘤患者中开展的SYMPHONY-1全球Ib/III期研究的Ib期部分公布令人鼓舞的数据(NCT04224493)。ORR为9%,而在使用III期临床试验推荐剂量的队列中,18个月的PFS和DoR[39]估计分别为94.4%和100%,并且未出现剂量限制性毒性。
他泽司他潜在的临床和关键注册审批进展:
- 预计于2024年年中提交用于三线以上治疗复发或难治性滤泡性淋巴瘤的中国新药上市申请。
HMPL-453是一种新型、高选择性及强效的FGFR 1/2/3抑制剂
- 于ASCO 2023年年会上首次公布人体研究数据;及
- 与国家药监局沟通后,启动正在进行中的用于治疗伴有FGFR 2融合的肝内胆管癌[40]患者的II期临床试验的注册阶段(NCT04353375)。
安迪利塞(amdizalisib,HMPL-689)是一种研究性,高选择性口服PI3Kδ[xli]抑制剂,旨在解决目前已获批及处于临床研究阶段的PI3Kδ抑制剂相关的胃肠道疾病和肝毒性
- 中国II期注册研究的滤泡性淋巴瘤队列已达到ORR主要终点,并获纳入突破性治疗药物品种(NCT04849351)。然而,根据近期与国家药监局的讨论,现在明确需要随机研究以支持注册。鉴于不断变化的监管要求,我们目前正在评估临床开发计划和监管方面的指引,再决定该适应症的注册审批策略。
IV.合作最新进展
完成与武田就呋喹替尼达成的除中国以外地区的全球独家许可
- 武田负责呋喹替尼在除中国内地、香港及澳门以外的全球范围的针对所有适应症的开发、生产及商业化;及
- 和黄医药可获得高达11.3亿美元的付款,其中包括已于2023年4月收到的4亿美元的首付款,以及可高达7.3亿美元的潜在额外的监管注册、开发及商业销售里程碑付款(其中3,500万美元的里程碑付款已在美国FDA批准后于2023年12月收取),外加生产费用和基于净销售额的特许权使用费。
两款由和黄医药发现的候选药物在创响生物[42]的推动下取得进一步临床进展
- 创响生物已启动两项IMG-007(一种抗OX40抗体)的全球IIa期研究,用于治疗中度至重度特应性皮炎成人患者和斑秃成人患者。已完成的I期研究显示其安全性及耐受性良好,并无出现另一种OX40疗法rocatinlimab中常见的发热或畏寒等不良反应;
- 创响生物已完成一项IMG-004的I期研究,IMG-004是一种用于治疗自身免疫性疾病的可逆性、非共价、高选择性的口服BTK[43]抑制剂。在这项单剂量递增研究中,IMG-004的安全性和耐受性良好,其半衰期长且药效持续时间长,远高于同类产品;及
- 创响生物已行使选择权以取得独家许可在全球进一步开发、生产和商业化上述两款候选药物,待2024年2月签署的约5%创响生物股份(完全稀释)的股份认购协议完成。
V. 其他业务
其他业务包括我们的盈利可观的处方药营销及分销平台
- 综合收入增长18%(按固定汇率计算为24%)至3.094亿美元(2022年:2.626亿美元);
- 上海和黄药业[44]非合并合资企业收入增长4%(按固定汇率计算为10%)至3.855亿美元(2022年:3.706亿元);
- 和黄医药应占其他业务的综合净收益减少8%(按固定汇率计算为3%)至5,030万美元(2022年:5,460万美元),主要乃由于因受到带量采购逐步调价的影响,上海和黄药业贡献的净收益减少4,740万美元(2022年:4,990万美元);
- 以510万美元出售HHOHK[45]和HSN[46];及
- 我们持续探索将合资企业上海和黄药业的潜在价值转化为实际价值的可能性,包括各种出售和股权资本市场选择方案。
VI.可持续发展
和黄医药致力于逐步将可持续发展融入我们营运的各个方面,并为我们的持份者创造长远价值。2023年,我们继续取得进展,包括:
- 在11项短期至长期目标和指标方面取得令人满意的进展;可持续发展目标和指标的绩效继续纳入管理层的绩效薪酬;
- 通过进行范围3排放筛选和测量,以及与供应商合作逐步实施可持续发展计划,加强气候行动。继2022年气候风险评估后,已对气候风险和机遇进行定期监测和审查;我们的气候行动将继续按照气候相关财务披露工作小组(“TCFD”)的建议进行披露;
- 通过引入数字数据收集平台来简化数据的收集、管理和报告,从而提高数据质量,确保提高数据的可靠性、可比性和透明度;
- 加强五个关键可持续发展支柱的调整,以涵盖与和黄医药最相关和最重要的可持续发展主题,包括(i)气候行动;(ii) 医疗保健获及性;(iii) 人力资本;(iv) 道德操守和透明度;及(v) 创新;
- 在主要的ESG评级和奖项中取得显著的改善,反映了和黄医药在可持续发展方面的努力得到了更广泛的认可;及
- 通过提前参考最新的可持续发展披露标准及行业特定披露标准来加强披露。
这些努力将继续引导和黄医药走向更可持续的未来。2023年可持续发展报告将于2024年4月与我们的2023年年报一起发布,其中将包括有关和黄医药可持续发展举措及其表现的进一步资料。
VII.新冠肺炎影响
尽管中国自2022年12月起逐步取消与新冠肺炎相关的限制性措施,然而新冠肺炎在2023年年初的数月里还是对我们的研究、临床试验和商业活动产生一定影响。我们已采取措施降低影响,自2023年第二季度起,上述活动已恢复常态。
财务摘要
汇率影响:2023年期间,人民币兑美元平均贬值约5%,这影响了我们的合并财务业绩,要点如下。
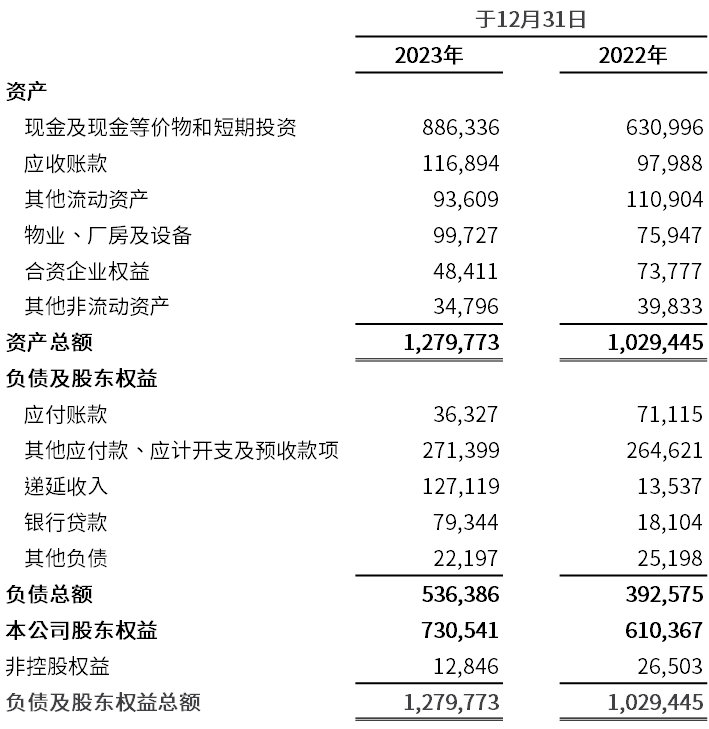
于2023年12月31日,现金及现金等价物和短期投资合计为8.863亿美元,而于2022年12月31日为6.31亿美元。
- 2023年,不包括融资活动的经调整后集团(非GAAP[47])净现金流为2.067亿美元(2022年:负2.979亿美元),主要由于收到武田的4.35亿美元首付款和里程碑付款;及
- 2023年,融资活动所得现金凈额总计4,870万美元,主要由于提取银行借款(2022年:融资活动所用现金凈额为8,280万美元)。
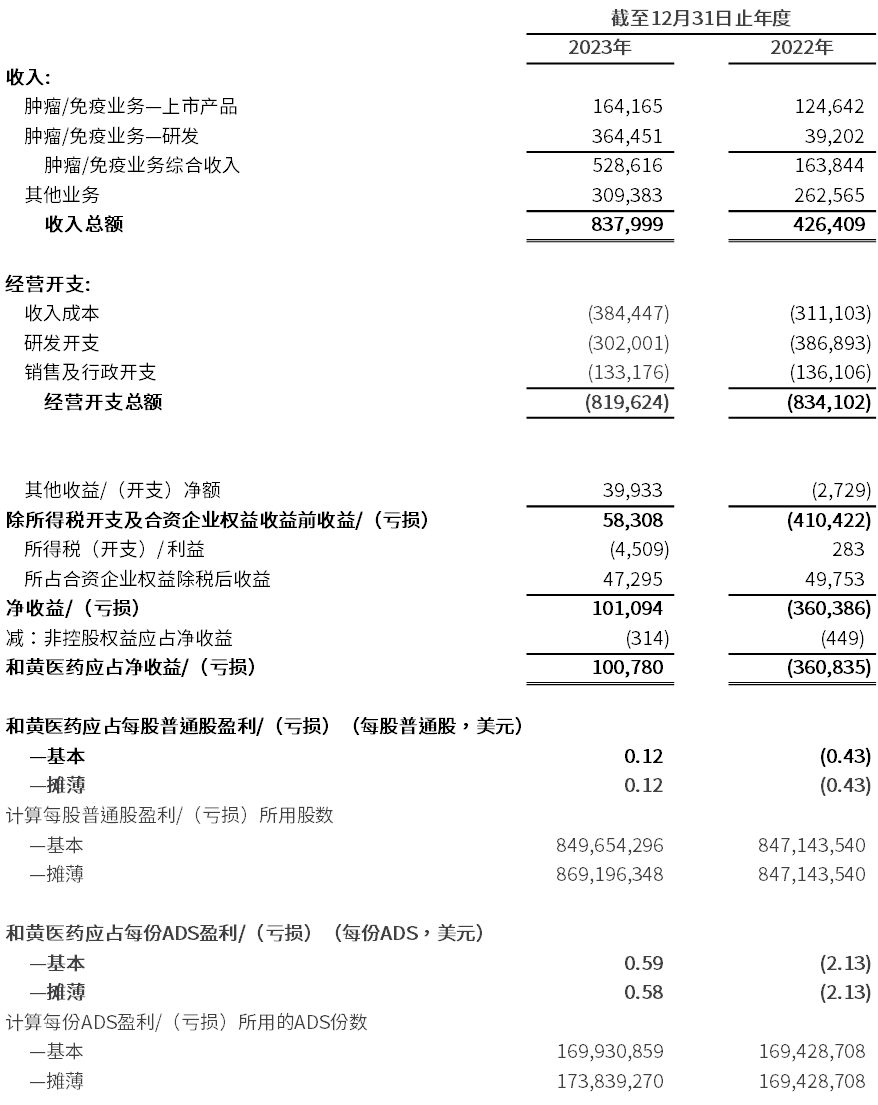
截至2023年12月31日止年度收入为8.38亿美元,而2022年为4.264亿美元。
- 肿瘤/免疫业务综合收入增长223%(按固定汇率计算为228%)至5.286亿美元(2022年:1.638亿美元),包括:
- 由于持续的市场份额增长(包括生产收入、推广及营销服务收入以及特许权使用费),爱优特®收入增长19%(按固定汇率计算为26%)至8,320万美元(2022年:6,990万美元);
- FRUZAQLA™收入为720万美元,反映了其于2023年11月初在美国上市,包括生产收入和特许权使用费;
- 由于我们持续的营销活动、患者覆盖面扩大及患者治疗生存期延长,苏泰达®收入增长36%(按固定汇率计算为43%)至4,390万美元(2022年:3,230万美元);
- 沃瑞沙®收入在2023年3月纳入国家医保药品目录后增加了30%(按固定汇率计算为37%)至2,890万美元(2022年:2,230万美元),包括生产收入和特许权使用费;
- 达唯珂®在海南先行区进一步销售后的收入为100万美元(2022年:10万美元);
- 合作收入为3.12亿美元,包含从武田4亿美元首付款中确认的2.8亿美元部分,及从武田3,500万美元里程碑付款中确认的3,200万美元部分;及
- 其他研发服务收入为5,240万美元(2022年:2,420万美元),主要与阿斯利康、礼来和武田管理开发及监管活动的费用有关。
- 其他业务综合收入增长18%(按固定汇率计算为24%)至3.094亿美元(2022年:2.626亿美元),主要得益于处方药的销售增加。该收入不包括上海和黄药业的非综合收入增长4%(按固定汇率计算为10%)至3.855亿美元(2022年:3.706亿美元)。
2023年的净开支为7.372亿美元,而2022年为7.872亿美元。
- 收入成本增加24% 至3.844亿美元(2022年:3.111亿美元),其中我们其他业务的收入成本因第三方处方药品销售增加而增加21% 至2.927亿美元(2022年:2.419亿美元)。肿瘤/免疫业务的收入成本增加33%至9,170万美元(2022年:6,920万美元),此乃由于我们已上市产品的销售额增加,以及因销售团队扩大而为爱优特®提供推广和营销服务的成本增加;
- 研发开支减少22%至3.02亿美元(2022年:3.869亿美元),减少主要是由于几项大型注册试验已完成,中国以外的发展以对外合作为主,以及在战略上持续优先我们的候选药物管线。我们在美国和欧洲的国际临床和注册申请业务产生1.069亿美元(2022年:1.709亿美元)的开支,而在中国的研发开支为1.951亿美元(2022年:2.16亿美元);
- 销售及行政开支[48]为1.332亿美元(2022年:1.361亿美元),减少主要是由于我们于2022年年底重组了美国肿瘤/免疫业务的商业营运,而我们的中国商业基础平台能够支持进一步的收入增长;及
- 其他项目主要包括上海和黄药业的合资企业权益收益、利息收入和支出,外汇和税务产生净收益8,240万美元(2022年:4,690万美元),增加主要是由于收到武田的4亿美元首付款后所赚取较高的利息收入。
2023年和黄医药应占净收益为1.008亿美元,而2022年应占凈亏损为3.608亿美元。
- 2023年和黄医药应占净收益为每股普通股0.12美元/每份ADS[49] 0.59美元,而2022年和黄医药应占净亏损为每股普通股0.43美元/每份ADS 2.13美元。
财务概要
简明综合资产负债表数据
(千美元)
简明综合经营表资料
(千美元,股份和每股数据除外)
展望和财务指引
2023 年对于和黄医药来说是表现出色的一年,很大程度上是因为从武田收取了4 亿美元的首付款,其中2.8 亿美元在2023 年期间确认为收入,其余部分将在约三年内于服务和履约义务完成时确认。
肿瘤/免疫业务综合收入的2024 年全年指引为 3.0 亿至 4.0 亿美元,主要得益于已上市的肿瘤产品30% 至 50%的目标收入增长。
在2024 年以及往后,和黄医药的工作将得到其强劲的财务状况的支持,截至2023 年12 月31 日,公司资产负债表的现金、现金等价物和短期投资增长了2.55亿美元,达到8.86亿美元。因此,公司完全有能力实现其建立自给自足可持续的业务,以及透过其在中国市场的销售网络和全球合作伙伴将创新药物带向全球患者的目标。
股东及投资者应注意:
- 我们不保证财务指引中包含的陈述将实现,或其中包含的财务业绩将实现或可能实现;及
- 我们过去曾修订我们的财务指引,因此应参考我们在本公告刊发日期后就任何财务指引更新的公告。
———
非GAAP财务指标的使用和调节―本公告中提及不包括融资活动的调整后集团净现金流及按照固定汇率计算报告的财务指标均基于非GAAP财务指标。请参阅下文的“非GAAP财务指标的使用和调节”,以分别了解这些财务指标的解释,以及这些财务指标与最具可比性的GAAP指标调节的进一步资料。
将于今天中国香港时间晚上8时30分 / 格林尼治标准时间下午12时30分 / 美国东部时间上午7时30分举行音频电话会议和网络直播(英语场次)。除了惯常的英语网络直播,我们亦将于2024年2月29日(星期四)中国香港时间上午8时30分举行中文(普通话)网络直播。登记后,投资者可透过和黄医药网站www.hutch-med.com/event/参与电话会议的音频网络直播。
希望加入电话会议并提出问题的参与者必须登记。登记后,每位参与者将获得拨入号码和一个独立的密码。
财务报表
和黄医药将于今天向美国证券交易委员会提交20-F表格的年度报告。
关于和黄医药
和黄医药(纳斯达克/伦敦证交所:HCM;香港交易所:13)是一家处于商业化阶段的创新型生物医药公司,致力于发现、全球开发和商业化治疗癌症和免疫性疾病的靶向药物和免疫疗法。集团旗下公司共有约5,000名员工,其中核心的肿瘤/免疫业务拥有约1,800人的团队。自成立以来,和黄医药致力于将自主发现的抗肿瘤候选药物带向全球患者,首三个肿瘤药物现已在中国上市,其中首个药物亦于美国上市。欲了解更多详情,请访问:www.hutch-med.com或关注我们的LinkedIn专页。
简称使用
除文意另有所指外,否则本公告中所称“集团”、“公司”、“和黄医药”、“和黄医药集团”、“我们”和“我们的”指和黄医药(中国)有限公司及其附属公司,除非文中另有说明或指明。
过往业绩和前瞻性陈述
本公告所载本集团之表现和经营业绩属历史性质,且过往表现并不保证本集团之未来业绩。本公告包含符合1995年《美国私人证券诉讼改革法案》中“安全港”条款定义的前瞻性陈述。该等前瞻性陈述可以用诸如“将会”、“期望”、“预期”、“未来”、“打算”、“计划”、“相信”、“估计”、“筹备”、“可能”、“潜在”、“同类首创”、“同类最佳”、“旨在”、“目标”、“指导”、“追求”或类似术语,或通过对潜在候选药物、潜在候选药物适应症的明示或暗示讨论,或通过讨论战略、计划、预期或意图来识别。阁下请勿过分倚赖这些前瞻性陈述。该等前瞻性陈述反映了管理层根据目前的信念和期望而对未来事件的预期,并受到已知及未知风险与不确定性的影响。如若该等风险或不确定性中的一项或多项出现,或者基本假设被证明属不正确,则实际结果可能与前瞻性陈述中所载之结果有重大出入。和黄医药不能保证其任何候选药物均将会在任何市场上获准销售,任何已取得的批准将于日后继续有效及生效,或者由和黄医药及/或其合作伙伴销售或以其他方式将产品商业化(统称“和黄医药产品”)将达到任何特定的收入或净收益水平。和黄医药管理层的预期可能会受到以下因素的影响:意料之外的监管行动或延迟或一般性的政府监管,其中包括和黄医药的ADS可能因《外国公司责任法案》及其下颁布的规则而被禁止在美国交易的风险;研究与开发中固有的不确定性,包括无法满足关键的关于受试者的注册率、时机和可用性的研究假设,其要符合研究的纳入及排除标准以及资金要求,临床方案的变更、意外不利事件或安全性、品质或生产方面的问题;候选药物无法满足硏究的主要或次要评估指标;候选药物无法获得不同司法管辖区的监管批准或和黄医药产品获得监管批准后的使用情况,市场认受性及商业成功;所发现、开发及/或商业化的竞争产品和候选药物可能比和黄医药产品及候选药物更有优势或更具成本效益;政府当局和其他第三方的研究(无论由和黄医药或其他人士进行及无论属强制或自愿)或建议及指引对和黄医药产品及开发中的候选药物的商业成功的影响;和黄医药制造及管理多种产品及候选药物供应链的能力;和黄医药产品能否从第三方支付机构获得报销及获报销的程度,包括私人支付机构的医疗健康及保险计划以及政府保险计划;开发、生产及销售和黄医药产品的成本;和黄医药实现其任何财务预测或指引的能力以及该等预测或指引所依据的假设的变化;遏制医疗成本的全球趋势,包括持续的价格压力;实际和潜在法律程序的不确定性,其中包括实际或潜在产品责任诉讼、有关销售和行销行为的诉讼和调查、知识产权纠纷以及一般性的政府调查;以及整体经济和行业状况,包括许多国家持续疲弱的经济和金融环境影响的不确定性、未来全球汇率的不确定性以及流行病和疾病暴发的影响的不确定性。有关前述各项和其他风险的进一步讨论,请参阅和黄医药向美国证券交易委员会、伦敦证券交易所和香港交易所[50]提交的文件。和黄医药在本公告中提供之资料截至本公告日期,并且不承担因新的资料、未来事件或其他原因而更新任何前瞻性陈述的义务。
此外,本公告包含和黄医药从行业出版物和第三方市场研究公司作出的报告中获得的统计数据和估计。尽管和黄医药认为该等出版物、报告和调查研究是可靠的,但是和黄医药尚未独立验证该等数据,不能保证该等数据的准确性或完整性。请阁下注意不要过度考虑该等数据。该等数据涉及风险和不确定性,并可能根据各种因素(包括前述因素)有所更改。
内幕消息
本公告包含(欧盟)第596/2014号条例(该条例构成《2018年欧洲联盟(退出)法》定义的欧盟保留法律的一部分)第7条规定的内幕消息。
医疗信息
本公告所提到的产品可能并未在所有国家上市,或可能以不同的商标进行销售,或用于不同的病症,或采用不同的剂量,或拥有不同的效力。本文中所包含的任何信息都不应被看作是任何处方药的申请、推广或广告,包括那些正在研发的药物。
[1] 武田 = Takeda Pharmaceuticals International AG,Takeda Pharmaceutical Company Limited的附属公司
[2] 研发 = 研究与发现 (R&D)
[3] 新药上市申请 = New Drug Application (NDA)
[4] 非小细胞肺癌 = Non-small cell lung cancer (NSCLC)
[5] PDUFA=《处方药使用者付费法案》(U.S. Prescription Drug User Fee Act)
[6] FDA = 美国食品药品监督管理局 (Food and Drug Administration)
[7] 结直肠癌 = Colorectal cancer (CRC)
[8] NCCN = 国家综合癌症网络 (National Comprehensive Cancer Network)
[9] 市场销售额 = 由礼来(爱优特®)、武田(FRUZAQLA™)、阿斯利康(沃瑞沙®)及和黄医药(爱优特®、苏泰达®、沃瑞沙®及达唯珂®)向第三方的总销售额
[10] EMA = 欧洲药品管理局 (European Medicines Agency)
[11] 上市许可申请 = Marketing Authorization Application (MAA)
[12] PMDA = 日本医药品和医疗器械局 (Pharmaceuticals and Medical Devices Agency)
[13] 子宫内膜癌 = Endometrial cancer (EMC)
[14] 肾细胞癌 = Renal cell carcinoma (RCC)
[15] 国家药监局 = 中国国家药品监督管理局 (NMPA)
[16] Syk = 脾酪氨酸激酶 (Spleen tyrosine kinase)
[17] 免疫性血小板减少症 = Immune thrombocytopenia purpura (ITP)
[18] 阿斯利康 = AstraZeneca AB,AstraZeneca PLC的附属公司
[19] 固定汇率 = Constant exchange rate (CER)。我们亦报告按固定汇率 (CER),一种非GAAP指标,计算业绩变化。请参阅下文的“非GAAP财务指标的使用和调节”,以分别了解这些财务指标的解释,以及这些财务指标与最具可比性的GAAP指标的对账
[20] 资料来源:IQVIA,报告存档
[21] TPO = 血小板生成素 (thrombopoietin); TPO-RA = 血小板生成素受体激动剂 (thrombopoietin receptor agonists)
[22] MET = 间充质上皮转化因子 (Mesenchymal epithelial transition factor)
[23] EGFR = 表皮生长因子受体 (Epidermal growth factor receptor)
[24] TKI = 酪氨酸激酶抑制剂 (Tyrosine kinase inhibitor)
[25] 国家医保药品目录 = 《国家基本医疗保险、工伤保险和生育保险药品目录》
[26] 礼来 = 礼来公司 (Eli Lilly and Company)
[27] VEGFR = 血管内皮生长因子受体 (Vascular endothelial growth factor receptor)
[28] ASCO =美国临床肿瘤学会 (American Society of Clinical Oncology)
[29] PFS = 无进展生存期 (Progression-free survival)
[30] ORR = 客观缓解率 (Objective response rate)
[31] DCR = 疾病控制率 (Disease control rate)
[32] OS = 总生存期 (Overall survival)
[33] PD-1 = 程序性细胞死亡蛋白-1 (Programmed cell death protein-1)
[34] FGFR = 成纤维细胞生长因子受体 (Fibroblast growth factor receptor)
[35] CSF-1R = 集落刺激因子 -1 受体 (Colony-stimulating factor 1 receptor)
[36] AACR = 美国癌症研究协会 (American Association for Cancer Research)
[37] 自身免疫性溶血性贫血 = Autoimmune hemolytic anemia (AIHA)
[38] Ipsen = Ipsen SA,Epizyme Inc 的母公司
[39] DoR = 缓解持续时间 (Duration of response)
[40] 肝内胆管癌 = Intrahepatic cholangiocarcinoma (IHCC)
[41] PI3Kδ = 磷酸肌醇 -3- 激酶δ (Phosphoinositide 3-kinase delta)
[42] 创响生物 = Inmagene Biopharmaceuticals
[43] BTK = 布鲁顿酪氨酸激酶 (Bruton’s tyrosine kinase)
[44] 上海和黄药业 = 上海和黄药业有限公司 (Shanghai Hutchison Pharmaceuticals Limited, SHPL)
[45] HHOHK = Hutchison Hain Organic (Hong Kong) Limited
[46] HSN = HUTCHMED Science Nutrition Limited
[47] GAAP = 一般公认会计原则 (Generally Accepted Accounting Principles)
[48] 销售及行政开支 = 销售、管理及行政开支 (Selling, general, and administrative expenses, SG&A)
[49] ADS = 美国预托证券 (American depositary share)
[50] 香港交易所 = 香港联合交易所有限公司主板
| 公告发布:2024年2月28日 (星期三) |
| 中国时间 晚上7时30分 (6:30am EST / 11:30am GMT) |
| >> 查看公告 << |
| 简报会网络直播及电话会议 |
| ⯈ 英文场次:2024年2月28日 (星期三) |
| 中国时间 晚上8时30分 (7:30am EST / 12:30pm GMT) |
| 收听网络直播回放 (英文场次) |
| ⯈ 中文(普通话)场次:2024年2月29日 (星期四) |
| 中国时间 上午8时30分 (7:30pm EST / 12:30am GMT) |
| 注册收听网络直播 (中文场次) |
| 欲通过电话拨入参与会议的投资者和分析师,请使用以下链接注册获取拨入详情: |
中国香港、上海和美国新泽西州:2024年2月7日,星期三:和黄医药(中国)有限公司(简称“和黄医药”或“HUTCHMED”)(纳斯达克/伦敦证交所:HCM;香港交易所:13)今日宣布于2024年2月6日举行的美国临床肿瘤学会全体大会系列会议(“ASCO Plenary Series”)上公布呋喹替尼联合紫杉醇用于二线治疗晚期胃癌患者的FRUTIGA III期研究的数据。完整的报告可于此处查看。呋喹替尼是一种选择性的口服血管内皮生长因子受体(“VEGFR”)1、2和3抑制剂,VEGFR抑制剂在抑制肿瘤的血管生成中起到了至关重要的作用。
ASCO Plenary Series的设立旨在覆盖癌症治疗领域可改变临床实践并具有重要临床意义的研究的最新进展。[i]
FRUTIGA研究(clinicaltrials.gov 注册号NCT03223376)是一项在中国35个临床中心的703名患者中开展的1:1随机、双盲的III期临床试验,旨在评估呋喹替尼和紫杉醇联合疗法对比紫杉醇单药疗法二线治疗晚期胃癌或胃食管结合部患者。研究的双主要终点研究包括无进展生存期(“PFS”)及总生存期(“OS”),当PFS终点根据预设的alpha显著性水平取得统计学意义的显著改善后,该研究宣布取得阳性结果。
接受呋喹替尼和紫杉醇联合疗法的患者的中位PFS 为5.6 个月,而接受紫杉醇单药疗法的患者的中位PFS 为2.7 个月,取得了具有统计学意义的显著改善(分层风险比 [“HR”] = 0.569;p < 0.0001)。 呋喹替尼联合疗法组的客观缓解率(“ORR”)显著提高(42.5% 对比 22.4%)。
OS出现改善但未达统计学意义,中位 OS 为 9.6 个月对比8.4 个月。 两组患者后续接受的抗肿瘤治疗比例不平衡,呋喹替尼和紫杉醇联合疗法组为 52.7%,而紫杉醇单药疗法组为 72.2%。 预设的敏感性分析表明,在没有接受后续抗肿瘤治疗的患者中,OS 的改善达到了统计学显著。 接受联合疗法的患者的中位 OS 为 6.9 个月,而接受安慰剂的患者为 4.8 个月,HR 为 0.72 (p = 0.0422)。
呋喹替尼在多个其他终点上均表现出具有统计学意义的显著改善,包括疾病控制率(“DCR”)为77.2% 对比56.3%,延长缓解持续时间(“DoR”)为5.5 个月对比3.7 个月。 最常见(至少5%)的3 级或以上治疗相关不良事件包括中性粒细胞减少症(60.0% 对比 36.4%)、白血球减少症(42.9% 对比 23.5%)、贫血(11.7% 对比 10.6%)和掌跖红肿综合征(8.9% 对比4.9%)。 因此,呋喹替尼和紫杉醇联合疗法的耐受性良好,安全性特征与预期一致。
该报告总结中提到,对于氟嘧啶或含铂化疗失败的晚期胃或胃食道腺癌患者来说,呋喹替尼和紫杉醇的联合疗法有可能成为有潜力的二线治疗选择。
| 报告标题 | 报告人 /主要作者 | 报告详情 |
|
呋喹替尼联合紫杉醇对比紫杉醇用于二线治疗晚期胃癌或胃食管结合部腺癌(FRUTIGA研究):一项随机、多中心、双盲、安慰剂对照的III期研究 Fruquintinib plus paclitaxel versus paclitaxel as second-line therapy for patients with advanced gastric or gastroesophageal junction adenocarcinoma (FRUTIGA): a randomized, multicenter, double-blind, placebo-controlled, phase 3 study |
徐瑞华,医学博士(MD, PhD) | ASCO Plenary Series 二月会议 摘要编号:438730 2024年2月6日 (星期二) 美国东部时间下午3时 (格林尼治标准时间下午8时,中国香港时间上午4时) |
呋喹替尼和紫杉醇联合疗法用于二线治疗晚期胃癌和胃食管结合部腺癌的中国新药上市申请已于2023年4月获中国国家药品监督管理局受理。呋喹替尼已于中国和美国获批用于治疗特定的转移性结直肠癌患者。
关于ASCO Plenary Series
根据美国临床肿瘤学会(“ASCO”」)的数据显示,ASCO Plenary Series的设立旨在覆盖癌症治疗领域可改变临床实践并具有重要临床意义的研究的最新进展。每场会议最多展示两篇摘要,并设有讨论演讲(discussant presentation)和现场问答环节。 该会议由ASCO建立,以便研究者和临床医生能够在学术会议的空档期保持紧贴肿瘤学的前沿研究,令有望改变临床实践的最新科学更快传播,帮助临床医生为患者提供最新的护理和治疗。
ASCO Plenary Series上展示的摘要需要解决新的科学问题、具有详尽的临床观察,并涵盖II 期和 III 期随机临床试验形式的主要科学数据,或者具有改变临床实践潜力的创新及影响力的原创研究。该会议上报告的研究通常也会于 ASCO 年会上以口头报告的形式发表。
关于FRUTIGA III期研究
FRUTIGA研究是一项在中国开展的随机双盲的III期临床试验,旨在评估呋喹替尼和紫杉醇联合疗法对比紫杉醇单药疗法二线治疗晚期胃癌患者。该研究共纳入了703名患者,研究的双主要终点研究包括PFS及总生存期OS。该研究的PFS终点取得具有统计学意义和临床意义的显著改善。OS终点尽管在中位OS上观察到改善,但按照预设的统计计划未取得统计学显著性。呋喹替尼在客观缓解率(ORR)、DCR和DoR在内的次要终点亦均观察到具有统计学意义的显著改善。呋喹替尼在FRUTIGA研究中的安全性特征与既往研究中观察到的一致。该项研究的其他详情可登录clinicaltrials.gov,检索注册号NCT03223376查看。
关于胃癌
胃癌是始于胃部的癌症。在2020年,胃癌是全球第五大常见癌症,据估计在全球范围内造成约77万例死亡。[ii] 在中国,据估计新增超过478,000例胃癌新症,并造成374,000人死亡。[iii]
关于呋喹替尼
呋喹替尼是一种选择性的口服VEGFR-1、-2及-3抑制剂。VEGFR抑制剂在抑制肿瘤的血管生成中起到至关重要的作用。呋喹替尼被设计为拥有更高的激酶选择性,旨在降低脱靶激酶活性,从而实现更高的药物暴露、对靶点的持续覆盖以及当潜在作为联合疗法时拥有更高的灵活度。迄今为止,呋喹替尼展示出可控的安全性特征,其与其他抗肿瘤疗法联合使用的研究正在进行中。
关于呋喹替尼在中国获批
呋喹替尼已于中国获批上市,并由和黄医药及礼来合作以商品名爱优特®上市销售。其于2020年1月获纳入中国国家医保药品目录。在中国416例转移性结直肠癌患者中开展的呋喹替尼III期关键性注册研究FRESCO的研究支持了呋喹替尼在中国的获批,该研究的结果已于2018年6月在《美国医学会杂志(JAMA)》上发表。自呋喹替尼在中国上市以来,截至2023年年中已经惠及超过8万名结直肠癌患者。
关于呋喹替尼在美国获批
呋喹替尼于2023年11月于美国获得批准,并由武田以商品名FRUZAQLA™上市销售。呋喹替尼的美国获批是基于两项大型III期研究的数据,包括已于《柳叶刀 (The Lancet)》发表结果的国际多中心FRESCO-2研究以及中国的FRESCO研究。这两项研究探索了呋喹替尼联合最佳支持治疗对比安慰剂联合最佳支持治疗用于治疗经治转移性结直肠癌患者。FRESCO和FRESCO-2研究均达到了其主要终点及关键次要疗效终点,在共734名接受了呋喹替尼治疗的患者中展示出了一致的获益。各项研究均展示出了一致的安全性特征。
关于和黄医药
和黄医药(纳斯达克/伦敦证交所:HCM;香港交易所:13)是一家处于商业化阶段的创新型生物医药公司,致力于发现、全球开发和商业化治疗癌症和免疫性疾病的靶向药物和免疫疗法。集团旗下公司共有约5,000名员工,其中核心的肿瘤/免疫业务拥有约1,800人的团队。自成立以来,和黄医药致力于将自主发现的抗肿瘤候选药物带向全球患者,首三个药物现已在中国上市,其中首个药物亦于美国上市。欲了解更多详情,请访问:www.hutch‑med.com或关注我们的领英专页。
前瞻性陈述
本新闻稿包含1995年《美国私人证券诉讼改革法案》“安全港”条款中定义的前瞻性陈述。这些前瞻性陈述反映了和黄医药目前对未来事件的预期,包括对呋喹替尼用于治疗晚期胃癌患者的治疗潜力的预期,以及呋喹替尼针对此适应症及其他适应症的进一步临床研究计划。前瞻性陈述涉及风险和不确定性。此类风险和不确定性包括下列假设:对研究时间和结果发布的预期、支持呋喹替尼在中国、美国、欧洲、日本、澳大利亚或其他地区获批用于治疗晚期胃癌的新药上市申请的数据充足性、获得监管部门快速审批或审批的潜力,呋喹替尼的安全性、和黄医药为呋喹替尼进一步临床开发计划及商业化提供资金并实现及完成的能力,此类事件发生的时间,以及新冠肺炎对整体经济、监管及政治状况带来的影响等。此外,由于部分研究赖于把其他药物产品如紫杉醇、替雷利珠单抗、信迪利单抗与呋喹替尼联合使用,因此此类风险和不确定性包括有关这些治疗药物的安全性、疗效、供应和监管批准的假设。当前和潜在投资者请勿过度依赖这些前瞻性陈述,这些陈述仅在截至本新闻稿发布当日有效。有关这些风险和其他风险的进一步讨论,请查阅和黄医药向美国证券交易委员会、AIM以及香港联合交易所有限公司提交的文件。无论是否出现新讯息、未来事件或情况或其他因素,和黄医药均不承担更新或修订本新闻稿所含讯息的义务。
医疗信息
本新闻稿所提到的产品可能并未在所有国家上市,或可能以不同的商标进行销售,或用于不同的病症,或采用不同的剂量,或拥有不同的效力。本文中所包含的任何信息都不应被看作是任何处方药的申请、推广或广告,包括那些正在研发的药物。
[i] Plenary Series FAQs | ASCO. Accessed January 31, 2024.
[ii] The Global Cancer Observatory, Stomach Cancer Fact Sheet. Accessed April 6, 2023.
[iii] The Global Cancer Observatory, China Fact Sheet. Accessed April 6, 2023.
联络方法
| 投资者咨询 | +852 2121 8200 / ir@hutch-med.com |
| 媒体咨询 | |
| Ben Atwell / Alex Shaw, FTI Consulting | +44 20 3727 1030 / +44 7771 913 902 (手机) / +44 7779 545 055 (手机) / HUTCHMED@fticonsulting.com |
| 周怡,博然思维集团 | +852 9783 6894(手机)/ HUTCHMED@brunswickgroup.com |
| 龙肇怡 / 何芷晴, 纵横公关集团 | +852 9282 4640 / +852 6198 4265(手机)/ SPRG_HUTCHMED@sprg.com.hk |
| 任命保荐人 | |
| Atholl Tweedie / Freddy Crossley / Daphne Zhang, Panmure Gordon | +44 (20) 7886 2500 |
中国香港、上海和美国新泽西州:2024年2月2日,星期五:和黄医药(中国)有限公司(简称“和黄医药”或“HUTCHMED”)(纳斯达克/伦敦证交所:HCM;香港交易所:13)今日宣布创响生物(Inmagene Biopharmaceuticals)根据2021年1月11日所宣布的战略合作条款,已行使与和黄医药发现的两款候选药物 IMG-007 和 IMG-004授权许可相关的选择权(以下简称“选择权”)。行使选择权并于和黄医药收到创响生物约7.5%的普通股股份(完全稀释)后,创响生物将取得在全球进一步开发、生产和商业化上述两款候选药物的独家权益。
作为合作协议的一部分,和黄医药向创响生物授予多种候选药物仅限于用于治疗免疫性疾病的独家选择权。 自选择权协议实施以来,创响生物注入资金并领导将其中两款候选药物IMG-004 和IMG-007推向临床开发。对于IMG-004 和IMG-007中的每款候选药物,和黄医药有权收取最高可达9,250万美元的开发里程碑付款和最高可达1.35亿美元的潜在的商业销售里程碑付款,以及商业化后分成。
2023年,创响生物启动了两项IMG-007(一种研究性的OX40拮抗性单克隆抗体)用于治疗中度至重度特应性皮炎和斑秃的全球IIa期临床试验。 它还完成了 IMG-004 的 I 期单次剂量递增(SAD)研究,IMG-004 是一种可逆、非共价、高选择性口服 BTK 抑制剂,旨在针对免疫性疾病。
和黄医药首席执行官兼首席科学官苏慰国博士表示:“这是该两种候选药物在免疫性疾病领域跨出的重要一步,并展示了和黄医药所发现的候选药物的潜力。 这项战略合作的成功是和黄医药自有的研发引擎以及我们开发部分创新候选药物所采取的合作战略的又一例证。 我们期待与创响生物继续合作,并期望看到这些候选药物为免疫性疾病的患者带来改变。”
关于创响生物
创响生物是一家处于临床阶段全球化的生物技术公司,专注于免疫及炎症疾病领域的新药开发。公司拥有多个同类最佳的具备高度差异化的临床阶段候选药物。领先的候选药物IMG-007是一种靶向OX40 的非耗竭性单克隆抗体,正在进行2项全球IIa期临床试验,用于治疗特应性皮炎和斑秃。IMG-004是一种非共价、可逆的BTK抑制剂,正在进行I期多剂量递增(MAD)研究。IMG-008是公司自主研发的长效抗IL-36R单克隆抗体,正进入全球I期临床开发阶段。
欲了解更多信息,请访问www.inmagenebio.com。
关于IMG-007
IMG-007是一种人源化抗OX40 IgG1单克隆抗体,具有更长的半衰期且没有抗体依赖性细胞介导的细胞毒性(ADCC)效应。OX40-OX40L轴在T细胞的激活、扩增和生存中扮演重要角色,在多种免疫及炎症疾病领域具有重要作用。临床前研究结果表明,IMG-007表现出能够选择性并有效阻断OX40与OX40L之间的信号传导。I期单次剂量递增(SAD)数据表明,在预期治疗剂量水平下,其半衰期为31天,可实现用药每12周一次(Q12W),与正在开发中的类似分子不同,其具备良好的安全性,并无出现发热和畏寒的情况。IMG-007正在进行两项IIa期试验,用于评估中度至重度特应性皮炎和斑秃。
关于IMG-004
IMG-004是为通常需要长期治疗嗯对炎症性和自身免疫性疾病而专门设计。IMG-004是一种可逆的、非共价、具有强效性、高选择性和脑渗透性的口服药。I期单次剂量递增(SAD)研究表明具有长半衰期和持久的药效动力学(PD)效应,这使其具备实现每日一次(QD)用药的可能性。于接下来的I期多剂量递增(MAD)研究中,IMG-004将被用于评估慢性自发性荨麻疹(CSU)和类风湿性关节炎(RA)。
关于和黄医药
和黄医药(纳斯达克/伦敦证交所:HCM;香港交易所:13)是一家处于商业化阶段的创新型生物医药公司,致力于发现、全球开发和商业化治疗癌症和免疫性疾病的靶向药物和免疫疗法。集团旗下公司共有约5,000名员工,其中核心的肿瘤/免疫业务拥有约1,800人的团队。自成立以来,和黄医药致力于将自主发现的抗肿瘤候选药物带向全球患者,首三个药物现已在中国上市,其中首个药物亦于美国上市。欲了解更多详情,请访问:www.hutch‑med.com或关注我们的领英专页。
前瞻性陈述
本新闻稿包含1995年《美国私人证券诉讼改革法案》“安全港”条款中定义的前瞻性陈述。这些前瞻性陈述反映了和黄医药目前对未来事件的预期,包括对IMG-004 和 IMG-007的治疗潜力的预期、对IMG-004 和 IMG-007进一步临床开发的预期,对IMG-004 和 IMG-007的临床研究是否达到其主要或次要终点的预期,以及对这些研究的完成和结果发布时间的预期。前瞻性陈述涉及风险和不确定性。这些风险和不确定性包括,除其他外,对研究时间和结果发布的预期、支持IMG-004 和 IMG-007于中国、美国、欧洲、日本等地区获批用于治疗特应性皮炎或其他适应症患者的临床数据充足性、IMG-004 和 IMG-007的疗效及安全性、创响生物为IMG-004 和 IMG-007进一步临床开发计划及商业化提供资金并实现及完成的能力、此类事件发生的时间、创响生物满足许可协议中的条款及条件的能力、有关临床方案获监管要求变更的假设、意料之外的不良事件或安全问题、IMG-004 和 IMG-007(包括作为联合治疗)达到研究的主要或次要终点的能力,在不同司法管辖区的获得监管批准,并在获批后获得商业认可、IMG-004 和 IMG-007针对目标适应症的潜在市场、资金充足性、创响生物成功开发、生产和商业化IMG-004 和 IMG-007的能力,以及新冠肺炎或其他传染疾病对整体经济、监管及政治状况带来的影响等。当前和潜在投资者请勿过度依赖这些前瞻性陈述,这些陈述仅在截至本新闻稿发布当日有效。有关这些风险和其他风险的进一步讨论,请查阅和黄医药向美国证券交易委员会、AIM以及香港联合交易所有限公司提交的文件。无论是否出现新讯息、未来事件或情况或其他因素,和黄医药均不承担更新或修订本新闻稿所含讯息的义务。
联络方法
| 投资者咨询 | +852 2121 8200 / +1 973 306 4490 / ir@hutch-med.com |
| 媒体咨询 | |
| Ben Atwell / Alex Shaw, FTI Consulting | +44 20 3727 1030 / +44 7771 913 902 (手机) / +44 7779 545 055 (手机) / HUTCHMED@fticonsulting.com |
| 周怡,博然思维集团 | +852 9783 6894(手机)/ HUTCHMED@brunswickgroup.com |
| 龙肇怡 / 何芷晴, 纵横公关集团 | +852 9282 4640 / +852 6198 4265(手机)/ SPRG_HUTCHMED@sprg.com.hk |
| 任命保荐人 | |
| Atholl Tweedie / Freddy Crossley / Daphne Zhang, Panmure Gordon | +44 (20) 7886 2500 |
Hong Kong, Shanghai & Florham Park, NJ — Thursday, February 1, 2024: HUTCHMED (China) Limited (“HUTCHMED”) (Nasdaq/AIM: HCM; SEHK:13) will be announcing its final results for the year ended December 31, 2023 on Wednesday, February 28, 2024 at 6:30 am Eastern Standard Time (EST) / 11:30 am Greenwich Mean Time (GMT) / 7:30 pm Hong Kong Time (HKT).
Analysts and investors are invited to join a conference call and audio webcast presentation with Q&A, conducted by HUTCHMED management.
The English conference call and audio webcast will take place at 7:30 am EST / 12:30 pm GMT / 8:30 pm HKT on Wednesday, February 28, 2024. In addition to the usual English webcast, there will also be a Chinese (Putonghua) webcast at 7:30 pm EST / 12:30 am GMT / 8:30 am HKT on Thursday, February 29, 2024. Both webcasts will be available live via the company website at www.hutch-med.com/event/. The presentation will be available for downloading before the conference call begins. Details of the conference call dial-in will be provided in the financial results announcement and on the company website. A replay will also be available on the website shortly after the event.
About HUTCHMED
HUTCHMED (Nasdaq/AIM:HCM; HKEX:13) is an innovative, commercial-stage, biopharmaceutical company. It is committed to the discovery and global development and commercialization of targeted therapies and immunotherapies for the treatment of cancer and immunological diseases. It has approximately 5,000 personnel across all its companies, at the center of which is a team of about 1,800 in oncology/immunology. Since inception it has focused on bringing cancer drug candidates from in-house discovery to patients around the world, with its first three medicines marketed in China, the first of which is also marketed in the U.S. For more information, please visit: www.hutch‑med.com or follow us on LinkedIn.
CONTACTS
Investor Enquiries |
+852 2121 8200 / +1 973 306 4490 / ir@hutch-med.com |
Media Enquiries |
|
| Ben Atwell / Alex Shaw, FTI Consulting | +44 20 3727 1030 / +44 7771 913 902 (Mobile) / +44 7779 545 055 (Mobile) / HUTCHMED@fticonsulting.com |
| Zhou Yi, Brunswick | +852 9783 6894 (Mobile) / HUTCHMED@brunswickgroup.com |
Nominated Advisor |
|
| Atholl Tweedie / Freddy Crossley / Daphne Zhang, Panmure Gordon | +44 (20) 7886 2500 |