和黃醫藥公佈2024年中期業績及最新業務進展
和黃醫藥(中國)有限公司(簡稱「和黃醫藥」、「本公司」或「我們」)今日公佈截至2024年6月30日止六個月的財務業績以及提供關鍵臨床項目和商業化發展的最新進展。
公司將於今天中國香港時間晚上8時/英國夏令時間下午1時/美國東部夏令時間上午8時舉行網絡直播(英語場次),並於2024年8月1日(星期四)中國香港時間上午8時30分舉行中文(普通話)場次。投資者登記後可透過和黃醫藥網站(www.hutch-med.com/event)參與實時網絡直播。
除另有說明外,所有金額均以美元列示。
收入增長勢頭持續,現金結餘充裕支持擴展
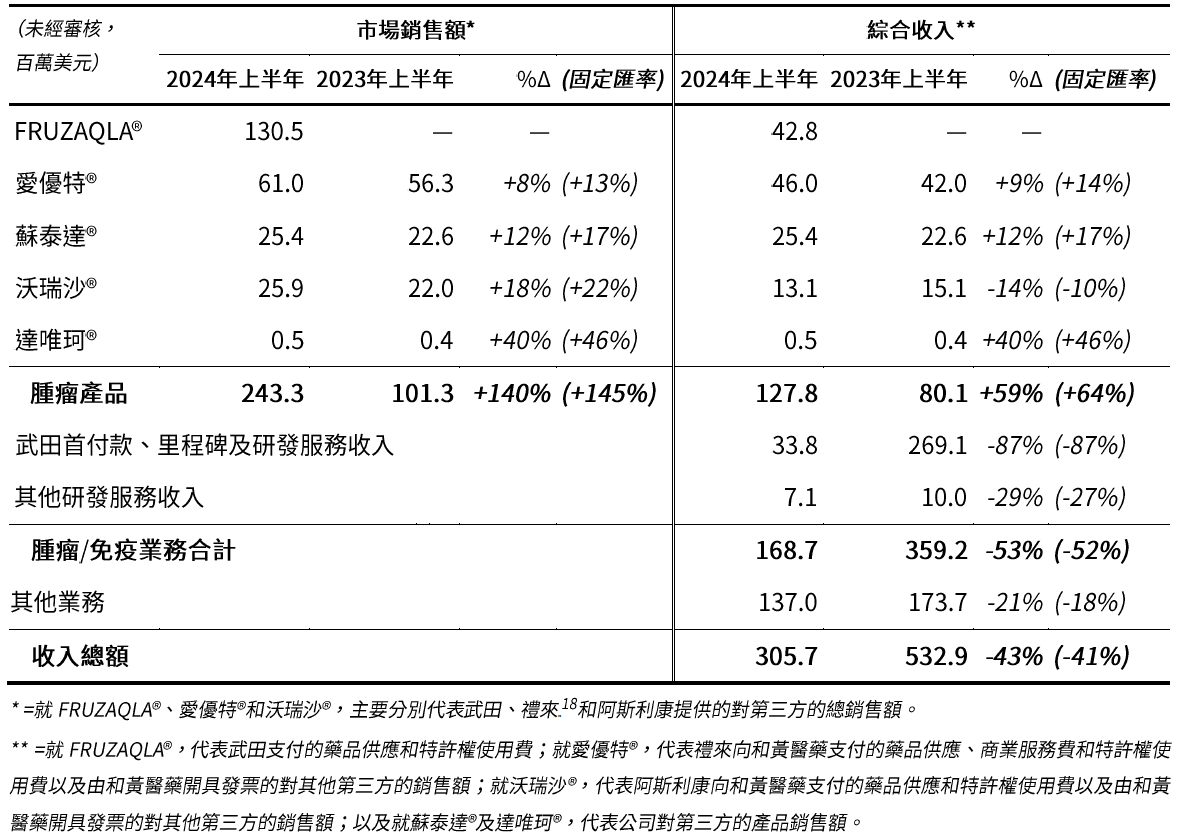
- 重申2024年全年腫瘤/免疫業務綜合收入財務指引為3億至4億美元,其中2024年上半年為1.687億美元,得益於59%(按固定匯率[1]計算為64%)的腫瘤產品收入增長。
- FRUZAQLA® 2024年上半年美國市場銷售額[2]為1.305億美元 ‒ 顯示自2023年11月上市以來,強勁的市場需求和商業吸引力。
- 2024年上半年淨收益為2,580萬美元。截至2024年6月30日現金餘額為8.025億美元,得益於我們持續提升關鍵研發[3]項目的優先級並提高商業效率。
呋喹替尼全球佈局持續推進,管線進一步拓寬並取得切實進展
- FRUZAQLA® 於2024年6月獲歐盟委員會批准後,正在合作夥伴武田[4]的帶領下為其在歐盟上市做準備 ‒ 在FRESCO-2研究的支持下,已在十幾個國家和地區提交上市許可申請。
- 和黃醫藥正為索樂匹尼布在中國上市做準備,用於治療免疫性血小板減少症[5] ‒ 有望成為公司首款血液學藥物,其新藥上市申請[6]已於2024年1月獲受理並獲納入優先審評。
- 基於SAVANNAH研究數據,有望於年底在美國提交賽沃替尼用於治療非小細胞肺癌[7]的新藥上市申請。
- 旨在在中國擴展沃瑞沙®和愛優特®的使用範圍和達唯珂®的新藥或新適應症上市申請已獲受理 — 分別用於治療MET外顯子14跳變[8]的非小細胞肺癌初治患者、子宮內膜癌患者和濾泡性淋巴瘤患者。
- 15項關鍵後期註冊試驗已啟動,目前正在進行/正在審評中 ‒ 涉及六種候選藥物:索樂匹尼布用於治療溫抗體型自身免疫性溶血性貧血[9]的ESLIM-02研究, HMPL-306用於治療急性髓系白血病[10]的RAPHAEL研究,以及索凡替尼用於治療胰腺導管腺癌[11]的研究。
- 持續壯大的血液學產品組合,在現有靶向Syk[12]、EZH2[13]、IDH[14]、BTK[15]和CD47的抑制劑和抗體產品組合的基礎上,新加入了靶向Menin和CD38的項目。
和黃醫藥非執行主席艾樂德(Dan Eldar)博士表示:「和黃醫藥在今年上半年表現強勁。團隊繼續實施我們的戰略並取得了重要的進展,持續發現和開發創新及有效的藥物;在中國本土市場和全球市場開展臨床試驗;及快速實現監管註冊和商業目標。我很高興看到我們與武田的合作繼續取得成功,也很高興看到公司為海外患者帶來醫療獲益的能力不斷增強。在此期間,我們在美國的收入持續增長,預計未來數月還將迎來在更多其他國家的收入增長。我們還會充分發揮我們在中國將新藥帶向市場,以及為已上市藥物擴展新適應症的良好經驗,期望在未來幾年取得多項潛在新藥上市申請批准。」
「我想藉此機會向剛剛退休的杜志強先生表示衷心感謝,杜先生見證了和黃醫藥的創立,並作出了重大貢獻,令和黃醫藥成長為一家全球性的創新型生物醫藥公司,致力於發現、開發和商業化癌症和免疫性疾病療法,以改善全球患者的生活質量。我期待著帶領公司邁入充滿潛力與希望的新發展階段。」
2024年中期業績及最新業務進展
和黃醫藥首席執行官兼首席科學官蘇慰國博士表示:「和黃醫藥團隊始終不懈努力,以保持我們近年來在臨床及監管註冊方面的良好勢頭,並推動已獲批產品取得商業上的成功。我要感謝每個人的辛勤工作及投入。與2023年上半年相比,我們的腫瘤產品收入增長了59%,與此同時,我們在推進研發管線時也更具側重性,擁有巨大潛力創造更高價值。我們在今年新啟動了三項關鍵性的後期研究,管線中目前共有十多項關鍵性研究正在進行中,有望在未來支持更多藥物審批。」
「我們為實現藥物全球化而採取的合作戰略,幫助我們在為內部研發引擎提供持續的動力,以及推動本土市場銷售的同時,將我們的創新藥物帶向全球更多地區的患者。FRUZAQLA®在武田帶領下的初步銷售表現令人讚賞,證明了我們藥物的品質及其在全球市場的潛力,以及驗證了我們在海外市場採取合作戰略的成效。」
「下半年我們將繼續推進各項註冊研究。我們期待在年底左右在中國取得索樂匹尼布的註冊批准,並在美國提交賽沃替尼的新藥上市申請。我們將繼續朝著成為一家可持續發展的生物醫藥企業這一目標邁進。」
I. 商業營運
腫瘤業務市場銷售額增長140%(按固定匯率計算為145%)至2.433億美元(2023年上半年:1.013億美元),得益於此,腫瘤產品綜合收入強勁增長59%(按固定匯率計算為64%)至1.278億美元(2023年上半年:8,010萬美元),主要包括以下重點:
- FRUZAQLA®(呋喹替尼的海外商品名)於2023年11月在美國上市,市場銷售額為1.305億美元(2023年上半年:無)。其強勁的業績得益於在美國市場獲患者快速接納,以及銷售渠道庫存需求的拉動;
- 愛優特®(ELUNATE®,呋喹替尼的中國商品名)市場銷售額增長8%(按固定匯率計算為13%)至6,100萬美元(2023年上半年:5,630萬美元),與結直腸癌[16]市場的增速一致,我們的市場份額在市場競爭加劇的情況下依然保持領先;
- 蘇泰達®(SULANDA®,索凡替尼)市場銷售額增長了12%(按固定匯率計算為17%)至2,540萬美元(2023年上半年:2,260萬美元),得益於醫生對該產品的認知度持續提升,令對神經內分泌瘤患者的可及性及市場份額提高; 及
- 沃瑞沙®(ORPATHYS®,賽沃替尼)市場銷售額增長了18%(按固定匯率計算為22%)至2,590萬美元(2023年上半年:2,200萬美元),得益於非小細胞肺癌患者中MET外顯子14跳變檢測及診斷的進步,以及在納入國家醫保藥品目錄[17]後第二年持續的增長勢頭。
腫瘤/免疫業務綜合收入包括腫瘤綜合產品收入,其中包括產品收入、商業服務費及特許權使用費,以及來自合作夥伴的研發收入,主要如下:
- 來自武田的首付款、里程碑及研發服務收入3,380萬美元(2023年上半年:2.691億美元),其中包括從4.35億美元的首付款和里程碑付款中確認的1,940萬美元,該款項已於2023年以現金形式從武田收到。相比之下,去年同期確認的款項為2.587億美元。
因此,腫瘤/免疫業務綜合收入總額為1.687億美元(2023年上半年:3.592億美元)。包括其他業務收入,總收入為3.057億美元(2023年上半年:5.329億美元)。
II.註冊審批進展
中國
- 賽沃替尼用於一線和二線治療MET外顯子14跳變非小細胞肺癌的新適應症上市申請[19]於2024年獲國家藥監局[20]受理;
- 2024年1月,呋喹替尼在中國香港獲批用於三線治療結直腸癌;
- 呋喹替尼用於二線治療子宮內膜癌的新適應症上市申請於2024年年初獲國家藥監局受理並獲納入優先審評;
- 2024年5月,他澤司他在中國香港獲批用於治療復發/難治性[21]濾泡性淋巴瘤;及
- 2024年7月,他澤司他用於治療復發/難治性濾泡性淋巴瘤的新藥上市申請獲國家藥監局受理並獲納入優先審評。
中國以外
- 呋喹替尼於2024年4月取得歐洲藥品管理局[22]人用藥品委員會的積極意見,用於治療經治的轉移性結直腸癌,並隨後於2024年6月在歐盟獲批。
III.後期臨床項目進展
賽沃替尼(中國商品名:沃瑞沙®)是一種高選擇性口服的MET[23]抑制劑
- 完成SAVANNAH研究的患者招募(NCT03778229),該關鍵性全球II期研究在因MET擴增或過表達導致泰瑞沙®治療後疾病進展的非小細胞肺癌患者中展開,已獲快速通道開發項目資格,並有望於美國申請加速審批。在該患者群體中進行的一項小型平行研究(NCT04606771)於AACR[24]年會上發表的數據亦證實了該聯合療法擁有更高的臨床活性,且安全性與各項治療的已知特徵保持一致;及
- 多項研究繼續入組中,包括SAFFRON研究(NCT05261399),這項在該患者群體中展開的與泰瑞沙®聯合療法的全球關鍵性III期研究,將為SAVANNAH研究提供進一步支持;SACHI研究(NCT05015608),一項在EGFR[25]抑制劑治療後疾病進展的中國患者中開展的類似的關鍵性III期研究,以及 SANOVO 研究(NCT05009836),一項用於一線治療伴有EGFR突變和MET過表達的中國患者的關鍵性III期研究。
賽沃替尼潛在的臨床和監管關鍵進展:
- 於2024年年底完成SACHI研究的患者招募;及
- 於2024年年底左右,基於SAVANNAH研究(若取得積極結果)向美國FDA[26]提交新藥上市申請。
呋喹替尼(中國商品名:愛優特®,海外商品名:FRUZAQLA®)是一種高選擇性的VEGFR 26F[27] 1/2/3口服抑制劑,旨在提高激酶選擇性,從而降低脫靶毒性
- FRUSICA-1研究結果公佈,這是一項與信迪利單抗(sintilimab)聯合療法用於治療伴有pMMR[28]狀態的子宮內膜癌患者的II期註冊研究,無論既往是否接受過貝伐珠單抗(bevacizumab)治療,該聯合療法均展現出具有意義的療效改善及可控的毒性特徵(NCT03903705);
- FRESCO-2研究的亞組分析於ASCO28F[29]年會公佈、生物標誌物分析於AACR年會公佈,及生活質量分析於ASCO GI[30] 會議公佈(NCT04322539)。分析表明,無論既往接受的治療種類或順序如何,該療法均是有效的,癌胚抗原[31]反應可能是療效改善的早期預測因素,以及在既往接受治療的結直腸癌患者中展現出具有臨床意義的生活質量調整後的生存獲益;及
- 繼於ASCO全體大會系列會議上首次公佈後,FRUTIGA研究結果於《自然 醫學》及ASCO年會上同步發表(NCT03223376),這是一項與紫杉醇聯合療法用於治療胃癌患者的中國研究。PFS[32]、ORR[33]和DCR[34]均取得具有統計學意義的顯著改善,儘管整體OS[35]改善未達統計學意義,但在排除接受後續抗腫瘤治療的患者後的預設分析中,OS改善達到了統計學意義上的顯著改善。
呋喹替尼潛在的臨床和監管關鍵進展:
- 於2024年年底完成治療經治轉移性結直腸癌的PMDA[36]新藥上市申請審評;及
- 若到達所需的PFS事件數量,於年底左右公佈用於治療腎透明細胞癌[37]的 II/III期註冊研究FRUSICA-2的頂線結果(NCT05522231)。
索樂匹尼布(HMPL-523)是一種研究性的高選擇性口服Syk抑制劑,Syk是Fc受體和B細胞受體信號傳導通路的關鍵組成部分
- ESLIM-01研究結果於《柳葉刀血液病學》及EHA[38]年會上同步發表,這是一項用於治療原發性免疫性血小板減少症成人患者的中國研究(NCT05029635)。索樂匹尼布治療不僅展現出具有臨床意義的快速且持久的48.4%的持續應答率以及可耐受的安全性特徵,還顯著改善了患者的生活質量,且無論患者既往的治療線數、既往TPO/TPO-RA[39]治療情況或類型,均帶來一致的臨床獲益;
- 用於治療溫抗體型自身免疫性溶血性貧血患者的中國II期概念驗證研究結果於EHA年會上發表,展現出良好的安全性特徵以及令人鼓舞的血紅蛋白獲益;及
- 基於這一積極的數據,啟動了該研究的III期階段,即ESLIM-02研究(NCT05535933)。
索樂匹尼布潛在的臨床關鍵進展:
- 於2024年年中在美國/歐洲啟動一項用於治療免疫性血小板減少症的劑量探索研究(NCT06291415);及
- 於年底左右完成基於 ESLIM-01研究的國家藥監局新藥上市申請審評。
索凡替尼(中國商品名:蘇泰達®)是一種VEGFR、FGFR 39F[40]及CSF-1R 40F[41]的口服小分子抑制劑,旨在用於抑制腫瘤血管生成,並通過調節腫瘤相關巨噬細胞以促進對腫瘤細胞的免疫應答
- 在中國啟動了一項用於治療初治轉移性胰腺導管腺癌的II/III期研究,聯合PD-1[42]抗體卡瑞利珠單抗(camrelizumab)、白蛋白結合型紫杉醇(nab-paclitaxel)及吉西他濱(gemcitabine)(NCT06361888)。該研究展開的部分依據是一項類似的由研究者發起的聯合療法研究,其數據已於2024年ASCO GI會議上公佈。據估計,每年全球約有1萬名患者被診斷患有這種高度侵襲性的癌症。
他澤司他(中國海南、澳門及香港商品名:達唯珂®)是一種同類首創EZH2口服抑制劑
- 有望於2025年年中完成中國新藥上市申請審評,用於治療復發/難治性濾泡性淋巴瘤。
HMPL-453是一種新型、高選擇性及強效的FGFR 1/2/3抑制劑
- 繼續II期註冊研究的患者招募,用於治療伴有FGFR 2融合的肝內膽管癌[43](NCT04353375)。
HMPL-306是一種IDH1和IDH2酶的研究性高選擇性口服雙重抑制劑,而這些酶被認為是某些血液惡性腫瘤、神經膠質瘤和實體瘤的驅動因素
- 中國和美國/歐洲I期研究的結果於EHA年會公佈,展現出其作為治療IDH1和/或IDH2突變型復發/難治性急性髓系白血病的有效療法的潛力(NCT04272957、NCT04764474);及
- 啟動RAPHAEL中國III期研究,用於治療IDH1和/或IDH2突變的復發/難治性急性髓系白血病(NCT06387069)。
其他早期研究性候選藥物
- 於AACR、ASCO和EHA年會上公佈了ERK1/2[44]抑制劑HMPL-295、第三代BTK抑制劑HMPL-760、Menin抑制劑HMPL-506,以及CD38 抗體偶聯藥物[45] HMPL-A067的臨床前和I期結果;及
- 於中國啟動HMPL-506的I期研究,用於治療血液惡性腫瘤(NCT06387082)。
IV.合作最新進展
兩款由和黃醫藥發現的候選藥物在創響生物 [46]的推動下取得進一步臨床進展
- 繼創響生物行使獨家許可選擇權以進一步開發、生產和商業化IMG-007(一種非消耗性抗OX40抗體)和IMG-004(一種可逆性、非共價、高選擇性的口服BTK抑制劑)後,獲得創響生物約7.5%(完全稀釋)的股份;
- 創響生物宣佈了IMG-007用於治療特應性皮炎的IIa期試驗的積極中期結果。治療令特應性皮炎患者的皮膚體徵得到快速、顯著和持久的改善,同時總體耐受性良好。最終結果預計將於2024年第三季度晚些時候公佈。創響生物還完成了斑禿IIa期試驗的患者招募;及
- 創響生物宣佈了IMG-004多劑量遞增研究的積極頂線結果,表明每日一次給藥的可行性。該藥物在每日一次的劑量範圍內服用10天均能良好耐受,沒有肝酶升高或出血事件報告。初步模型和數據支持每日一次50毫克作為潛在的治療劑量,並進一步開發作為BTK介導的免疫性疾病的差異化治療。
V. 其他業務
- 其他業務收入主要來自我們在中國的處方藥營銷及分銷業務。綜合收入下降了21%(按固定匯率計算為18%)至1.370億美元(2023年上半年:1.737億美元),主要是由於與新冠肺炎相關的處方藥的分銷銷售額於2024年下降。
- 非合併合資企業上海和黃藥業[47]的收入下降4%(按固定匯率計算為持平)至2.252億美元(2023年上半年:2.353億美元),主要受到麝香保心丸在幾個高定價省份的定價降低影響,該舉措旨在標準化麝香保心丸的定價結構,以為可能在全國範圍實施的帶量採購做好準備。
- 和黃醫藥應佔其他業務的綜合淨收益減少8%(按固定匯率計算為4%)至3,410萬美元(2023年上半年:3,720萬美元),主要是由於上海和黃藥業因帶量採購價格影響及增加研發開支,導致其貢獻的淨收益減少,為3,380萬美元(2023年上半年:3,510萬美元)。
- 我們持續探索將合資企業上海和黃藥業的潛在價值轉化為實際價值的可能性,包括各種出售和合作備選方案。
VI.可持續發展
和黃醫藥致力逐步將可持續發展融入各個營運方面,並為我們的持份者創造長遠價值。2024年4月,我們發佈了2023年可持續發展報告,重點闡述我們在11項目標和指標方面取得的進展;氣候行動的優化工作,包括進行了範圍3排放篩選和測量,並加強與供應商合作;數據質量的提升;更具協調性的五大可持續發展支柱;以及提前參考最新披露標準及行業特定披露標準的可持續發展披露。
我們的努力亦得到了更廣泛的認可。本地和國際上主要的可持續發展評級機構對和黃醫藥予以穩步提升的評級,這些評級來自恒生、ISS、MSCI、標普全球、Sustainalytics 和 Wind。近期,在標普全球ESG[48] 評分中,和黃醫藥更取得49分的佳績,大幅高于同行業平均分31分。此外,我們還榮獲了香港投資者關係協會頒發的「最佳 ESG(E)」、「彭博商業周刊-ESG領先企業」頒發的的兩項殊榮、新城財經台頒發的「灣區企業可持續發展大獎」五項大獎,以及入選E藥經理人中國醫藥上市公司ESG 競爭力20強等。
2024年,我們持續在上述方面努力,並通過進行更全面的氣候風險評估,量化氣候風險對我們主要業務的影響,進一步加強我們的氣候行動;將可持續發展融入我們的企業文化;以及開始計劃未來的目標和指標。
財務摘要
匯率影響:2024年上半年,人民幣兌美元平均貶值約4%,這影響了我們的綜合財務業績,要點如下。
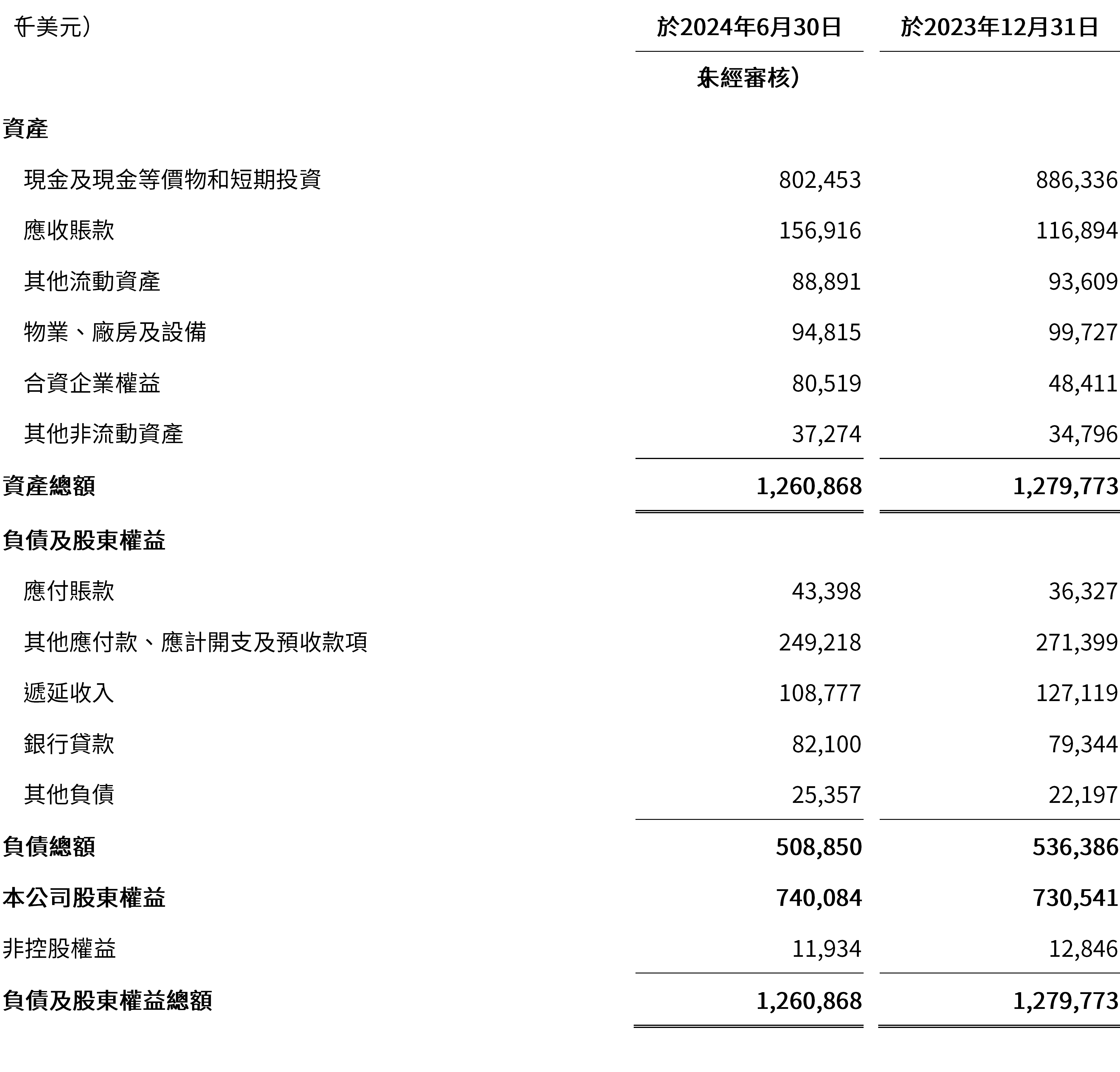
於2024年6月30日,現金及現金等價物和短期投資合計為8.025億美元,而於2023年12月31日為8.863億美元。
- 於2024年上半年,不包括融資活動的調整後的集團(非GAAP[49])淨現金流為-5,130萬美元(2023年上半年:2.193億美元),主要是由於經營活動所用淨現金3,980萬美元及資本支出1,010萬美元;及
- 2024年上半年融資活動使用的淨現金合計為3,260萬美元,乃由於購買了3,610萬美元的股權獎勵(2023年上半年:融資活動產生的淨現金為580萬美元)。
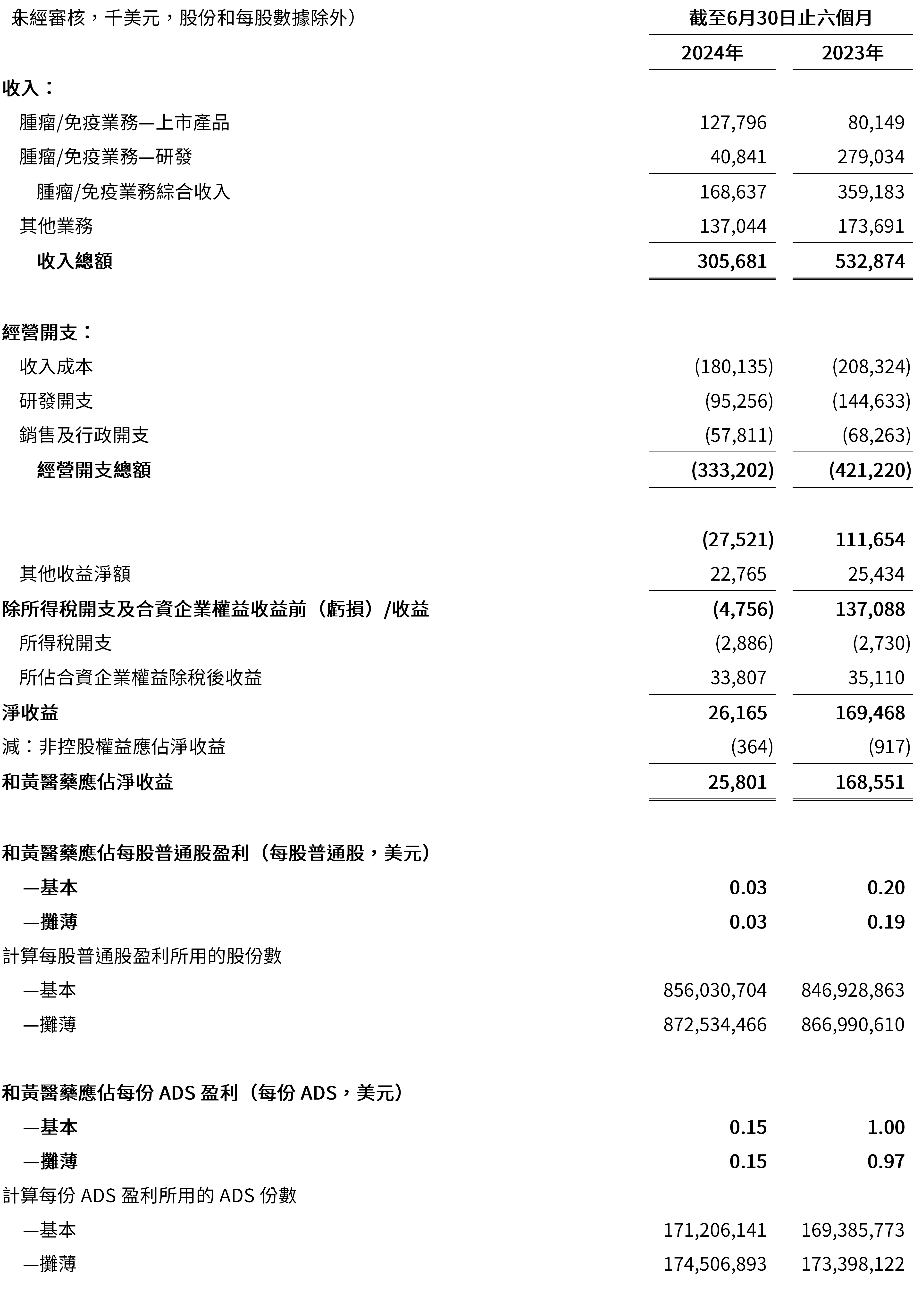
截至2024年6月30日止六個月收入為3.057億美元,而截至2023年6月30日止六個月為5.329億美元。
- 腫瘤/免疫業務綜合收入為1.687億美元(2023年上半年:3.592億美元),包括:
- FRUZAQLA®收入為4,280萬美元,反映了其自2023年11月初以來在美國成功上市,包括特許權使用費和生產收入;
- 於其上市以來的第六年內,愛優特®收入增長9%(按固定匯率計算為14%)至4,600萬美元(2023年上半年:4,200萬美元),包括生產收入、推廣及營銷服務收入以及特許權使用費,與結直腸癌市場的增速一致,我們的市場份額在市場競爭加劇的情況下依然保持領先;
- 蘇泰達®收入增長12%(按固定匯率計算為17%)至2,540萬美元(2023年上半年:2,260萬美元),國家醫保藥品目錄續約後銷售額持續增長,隨著醫生對該產品的認知度持續提升,令對神經內分泌瘤患者的可及性及市場份額提高;
- 沃瑞沙®收入下降14%(按固定匯率計算為10%)至1,310萬美元(2023年上半年:1,510萬美元),主要由於生產收入減少至530萬美元(2023年上半年:850萬美元),但被特許權使用費增至780萬美元(2023年上半年:660萬美元)所抵消,這反映了18%(按固定匯率計算為22%)的强勁市場銷售額增長;
- 達唯珂®收入為50萬美元(2023年上半年:40萬美元),主要來自海南先行區[50]的銷售;
- 武田首付款,里程碑付款及研發服務收入減少至3,380萬美元(2023年上半年:2.691億美元,即2023年4月從武田收到的4億美元現金首付款中已確認的2.587億美元部分); 及
- 其他研發服務收入為710萬美元(2023年上半年:1,000萬美元),主要與阿斯利康及禮來管理開發及監管活動的費用有關。
- 其他業務綜合收入下降21%(按固定匯率計算為18%)至1.370億美元(2023年上半年:1.737億美元),主要是由於與新冠肺炎相關的處方藥的分銷銷售額於2024年減少。該收入不包括上海和黃藥業的非綜合收入2.252億美元(2023年上半年:2.353億美元)。
截至2024年6月30日止六個月淨開支為2.799 億美元,而截至2023年6月30日止六個月為3.643 億美元,反映我們在成本控制方面作出的巨大努力。
- 收入成本下降14%至1.801億美元(2023年上半年:2.083億美元),其中源自其他業務的收入成本下降,但是被我們已上市產品的銷售額增加,以及因銷售團隊擴大而為愛優特®推廣和營銷服務的成本增加所抵消;
- 研發開支減少34%至9,530萬美元(2023年上半年:1.446億美元),主要由於我們對管線產品,特別是中國境外的管線產品進行戰略優先排序所致。美國和歐洲的臨床和監管申報費用為1,490萬美元(2023年上半年:5,560萬美元),而中國的研發開支為8,040萬美元(2023年上半年:8,900萬美元);
- 銷售及行政開支[51]為5,780萬美元(2023年上半年:6,830萬美元),減少主要由於我們對支出進行了更嚴格的控制,同時利用現有的基礎設施來推動進一步的收入增長;及
- 其他項目主要包括上海和黃藥業的合資企業權益收益、利息收入和支出,外匯和稅務產生淨收益5,330萬美元(2023年上半年:5,690萬美元),此下降主要由於該期間確認的匯兌收益降低。
截至2024年6月30日止六個月和黃醫藥應佔淨收益為2,580萬美元,而截至2023年6月30日止六個月為1.686億美元。
- 截至2024年6月30日止六個月,和黃醫藥應佔淨收益為每股普通股0.03美元/每份ADS[52] 0.15美元(2023年上半年:每股普通股0.20美元/每份ADS 1.00美元)。
財務指引
我們重申腫瘤/免疫業務綜合收入的2024年全年指引為3億至4億美元,主要得益於已上市的腫瘤產品30%至50%的目標收入增長。在2024年以及往後,和黃醫藥的工作將得到其強勁的財務狀況的支持。因此,公司完全有能力實現其建立自給自足可持續的業務,以及透過其在中國市場的銷售網絡和全球合作夥伴將創新藥物帶向全球患者的目標。
股東及投資者應注意:
- 我們不保證財務指引中包含的陳述將實現,或其中包含的財務結果將實現或可能實現;及
- 我們過去曾修訂我們的財務指引,應參考我們在本公告刊發日期後就任何財務指引更新的公告。
———
非GAAP財務指標的使用和調節—本公告中提及不包括融資活動的調整後集團淨現金流及按照按固定匯率計算報告的財務指標均基於非GAAP財務指標。請參見「非GAAP財務指標的使用和調節」,以分別瞭解這些財務指標的解釋,以及這些財務指標與最具可比性的GAAP指標調節的進一步資料。
———
財務概要
簡明綜合經營表資料
關於和黃醫藥
和黃醫藥(納斯達克/倫敦證交所:HCM;香港交易所:13)是一家處於商業化階段的創新型生物醫藥公司,致力於發現、全球開發和商業化治療癌症和免疫性疾病的靶向藥物和免疫療法。集團旗下公司共有約5,000名員工,其中核心的腫瘤/免疫業務擁有約1,800人的團隊。自成立以來,和黃醫藥致力於將自主發現的抗腫瘤候選藥物帶向全球患者,首三個癌症藥物現已在中國上市,其中首個藥物亦於美國上市。欲了解更多詳情,請訪問:www.hutch-med.com或關注我們的LinkedIn專頁。
聯絡方法
投資者諮詢 |
+852 2121 8200 / ir@hutch-med.com |
媒體諮詢 |
|
| Ben Atwell / Alex Shaw, FTI Consulting |
+44 20 3727 1030 / +44 7771 913 902 (手機) / +44 7779 545 055 (手機) HUTCHMED@fticonsulting.com |
|
周怡, 博然思維集團 |
+852 9783 6894(手機) |
|
龍肇怡 / 何芷晴, 縱橫公關集團 |
+852 9282 4640 / +852 6198 4265 (手機) |
任命保薦人 |
|
| Atholl Tweedie / Freddy Crossley/ Rupert Dearden, Panmure Liberum* |
+44 (20) 7886 2500 |
簡稱使用
除非文意另有所指外,否則本公告中所稱「集團」、「公司」、「和黃醫藥」、「和黃醫藥集團」、「我們」和「我們的」指和黃醫藥(中國)有限公司及其附屬公司,除非文中另有說明或指明。
過往業績和前瞻性陳述
本公告所載本集團之表現和經營業績屬歷史性質,且過往表現並不保證本集團之未來業績。本公告包含符合1995年《美國私人證券訴訟改革法案》「安全港」條款中定義的前瞻性陳述。該等前瞻性陳述可以用諸如「將會」、「期望」、「預期」、「未來」、「打算」、「計劃」、「相信」、 「估計」、「籌備」、「可能」、「潛在」、「同類首創」、「同類最佳」、「旨在」、「目標」、「指導」、「追求」或類似術語,或通過對潛在候選藥物、潛在候選藥物適應症的明示或暗示討論,或通過討論戰略、計劃、預期或意圖來識別。閣下請勿過分倚賴這些前瞻性陳述。該等前瞻性陳述反映了管理層根據目前的信念和期望而對未來事件的預期,並受到已知及未知風險與不確定性的影響。如若該等風險或不確定性中的一項或多項出現,或者基本假設被證明屬不正確,則實際結果可能與前瞻性陳述中所載之結果有重大出入。和黃醫藥不能保證其任何候選藥物均將會在任何市場上獲准銷售,也不能保證已獲得的任何批准在未來繼續有效,或者由和黃醫藥及/或其合作夥伴銷售或以其他方式將產品商業化(統稱「和黃醫藥產品」)將達到任何特定的收入或淨收益水平。和黃醫藥管理層的預期可能會受到以下因素的影響:意料之外的監管行動或延遲或一般性的政府監管,其中包括和黃醫藥的ADS可能因《外國公司責任法案》及其下頒佈的規則而被禁止在美國交易的風險;研究與開發中固有的不確定性,包括無法滿足關鍵的關於受試者的註冊率、時機和可用性的研究假設,其要符合研究的納入及排除標準以及資金要求,臨床方案的變更、意外不利事件或安全性、品質或生產方面的問題;候選藥物無法滿足硏究的主要或次要評估指標;候選藥物無法獲得不同司法管轄區的監管批准或和黃醫藥產品獲得監管批准後的使用情況,市場認受性及商業成功;所發現、開發及/或商業化競爭產品和候選藥物可能比和黃醫藥產品及候選藥物更有優勢或更具成本效益;政府當局和其他第三方的研究(無論由和黃醫藥或其他人士進行及無論屬強制或自願)或建議及指引對和黃醫藥產品及開發中的候選藥物的商業成功的影響;和黃醫藥製造及管理多種產品及候選藥物供應鏈的能力;和黃醫藥產品能否從第三方支付機構獲得報銷及獲報銷的程度,包括私人支付機構的醫療健康及保險計劃以及政府保險計劃;開發、生產及銷售和黃醫藥產品的成本;和黃醫藥實現其任何財務預測或指引的能力以及該等預測或指引所依據的假設的變化;遏制醫療成本的全球趨勢,包括持續的價格壓力;實際和潛在法律程序的不確定性,其中包括實際或潛在產品責任訴訟、有關銷售和行銷行為的訴訟和調查、知識產權糾紛以及一般性的政府調查;以及整體經濟和行業狀況,包括許多國家持續疲弱的經濟和金融環境影響的不確定性、未來全球匯率的不確定性以及流行病和疾病暴發的影響的不確定性。有關前述各項和其他風險的進一步討論,請參閱和黃醫藥向美國證券交易委員會、倫敦證券交易所和香港交易所[53]提交的文件。和黃醫藥在本公告中提供之資料截至本公告日期,並且不承擔因新的資料、未來事件或其他原因而更新任何前瞻性陳述的義務。
此外,本公告包含和黃醫藥從行業出版物和第三方市場研究公司作出的報告中獲得的統計數據和估計。儘管和黃醫藥認為該等出版物、報告和調查研究是可靠的,但是和黃醫藥尚未獨立驗證該等數據,不能保證該等數據的準確性或完整性。請閣下注意不要過度考慮該等數據。該等數據涉及風險和不確定性,並可能根據各種因素(包括前述因素)有所更改。
內幕消息
本公告載有條例(歐盟)第596/2014號(由於其構成2018年脫離歐盟法所界定保留歐盟法例的一部分)第7條所指的內幕消息。
醫療信息
本公告所提到的産品可能並未在所有國家上市,或可能以不同的商標進行銷售,或用於不同的病症,或採用不同的劑量,或擁有不同的效力。本文中所包含的任何信息都不應被視為是任何處方藥的申請、推廣或廣告,包括那些正在研發的藥物。
[1] 固定匯率 = Constant exchange rate (CER)。我們亦報告按固定匯率 (CER),一種非GAAP指標,計算業績變化。請參閲下文的「非GAAP財務指標的使用和調節」,以分別了解這些財務指標的解釋,以及這些財務指標與最具可比性的GAAP指標的對賬
[2] 市場銷售額 = 由禮來(愛優特®)、武田(FRUZAQLA®)、阿斯利康(沃瑞沙®)及和黃醫藥(愛優特®、蘇泰達®、沃瑞沙®及達唯珂®)向第三方的總銷售額
[3] 研發 = 研究與發現 (R&D)
[4] 武田 = Takeda Pharmaceuticals International AG,Takeda Pharmaceutical Company Limited的附屬公司
[5] 免疫性血小板減少症 = Immune thrombocytopenia purpura (ITP)
[6] 新藥上市申請 = New Drug Application (NDA)
[7] 非小細胞肺癌 = Non-small cell lung cancer (NSCLC)
[8] MET外顯子14 = MET外顯子14 跳變(MET exon 14 skipping alterations,METex14)
[9] 自身免疫性溶血性貧血 = Autoimmune hemolytic anemia (AIHA)
[10] 急性髓系白血病 = Acute myeloid leukemia (AML)
[11] 胰腺導管腺癌 = Pancreatic ductal adenocarcinoma (PDAC)
[12] Syk = 脾酪氨酸激酶 (Spleen tyrosine kinase)
[13] EZH2 = zeste基因增強子同源物2 (Enhancer of zeste homolog 2)
[14] IDH = 異檸檬酸脫氫酶 (Isocitrate dehydrogenase)
[15] BTK = 布魯頓酪氨酸激酶 (Bruton’s tyrosine kinase)
[16] 結直腸癌 = Colorectal cancer (CRC)
[17] 國家醫保藥品目錄 = 《中國國家基本醫療保險、工傷保險和生育保險藥品目錄》(NRDL)
[17] 禮來 = 禮來公司 (Eli Lilly and Company)
[19] 新適應症上市申請 = Supplemental New Drug Application (sNDA)
[20] 國家藥監局 = 中國國家藥品監督管理局 (China National Medical Products Administration, NMPA)
[21] 復發/難治性 = 復發及/或難治性 (Relapsed and/or refractory, R/R)
[22] EMA = 歐洲藥品管理局 (European Medicines Agency)
[23] MET = 間充質上皮轉化因子 (Mesenchymal epithelial transition factor)
[24] AACR = 美國癌症研究協會 (American Association for Cancer Research)
[25] EGFR = 表皮生長因子受體 (Epidermal growth factor receptor)
[26] FDA = 美國食品藥品監督管理局 (Food and Drug Administration)
[27] VEGFR = 血管內皮生長因子受體 (Vascular endothelial growth factor receptor)
[28] pMMR = 錯配修復完整 (Proficient mismatch repair)
[29] ASCO = 美國臨床腫瘤學會 (American Society of Clinical Oncology)
[30] ASCO GI = 美國臨床腫瘤學會胃腸道腫瘤研討會
[31] 癌胚抗原 = Carcinoembryonic antigen (CEA)
[32] PFS = 無進展生存期 (Progression-free survival)
[33] ORR = 客觀緩解率 (Objective response rate)
[34] DCR = 疾病控制率 (Disease control rate)
[35] OS = 總生存期 (Overall survival)
[36] PMDA = 日本醫藥品和醫療器械局 (Pharmaceuticals and Medical Devices Agency)
[37] 腎細胞癌 = Renal cell carcinoma (RCC)
[38] EHA=歐洲血液學協會 (European Hematology Association)
[39] TPO = 血小板生成素 (thrombopoietin); TPO-RA = 血小板生成素受體激動劑 (thrombopoietin receptor agonists)
[40] FGFR = 成纖維細胞生長因子受體 (Fibroblast growth factor receptor)
[41] CSF-1R = 集落刺激因子 -1 受體 (Colony-stimulating factor 1 receptor)
[42] PD-1 = 程序性細胞死亡蛋白-1 (Programmed cell death protein-1)
[43] 肝內膽管癌 = Intrahepatic cholangiocarcinoma (IHCC)
[44] ERK = 細胞外信號調節激酶 (Extracellular signal-regulated kinase)
[45] 抗體偶聯藥物 = Antibody-drug conjugate (ADC)
[46] 創響生物 = Inmagene Biopharmaceuticals
[47] 上海和黃藥業 = 上海和黃藥業有限公司 (Shanghai Hutchison Pharmaceuticals Limited, SHPL)
[48] ESG = 環境、社會及管治 (Environmental, Social and Governance)
[49] GAAP = 一般公認會計原則 (Generally Accepted Accounting Principles)
[50] 海南先行區 = 海南博鰲樂城國際醫療旅遊先行區 (Hainan Boao Lecheng International Medical Tourism Pilot Zone, Hainan Pilot Zone)
[51] 銷售及行政開支 = Selling and administrative expenses (S&A)
[52] ADS = 美國預託證券 (American depositary share)
[53] 香港交易所 = 香港聯合交易所有限公司主板